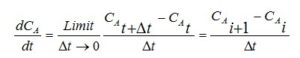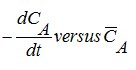Diferensiasi Grafis
Metode diferensial disebut juga metode laju awal atau metode laju rata-rata. Metode ini didasarkan pada perubahan konsentrasi pereaksi dalam selang waktu tertentu. Dengan kata lain metode diferensial adalah metode untuk menentukan tingkat reaksi. Metode diferrensial didasarkan atas penggunaan persamaan laju secara langsung. Adapun langkah-langkah penyelesaian menggunakan metode diferensial adalah sebagai berikut :
- Mencoba dengan menebak bentuk persamaan reaksi serta order reaksinya
- Menyusun neraca massa, hingga diperoleh persamaan diferensial linier
- Membuat grafik hubungan antara variable yang ada
- Apabila grafik berupa garis lurus berarti bentuk persamaan kecepatan reaksi yang dicoba atau ditebak benar, dan nilai konstanta kecepatan reaksi adalah slope dari garis tersebut
- Apabila garis dalam grafik tidak lurus, maka dicoba bentuk persamaan laju reaksi serta orde reaksi yang lain
- Melakukan prosedur yang sama sampai memperoleh garis lurus.
- Pengolahan data juga dapat dilakukan menggunakan metode least square, sampai diperoleh kesalahan rata-rata yang kecil (biasanya kurang dari 10 %).
Pada metode diferensial, variable dalam bentuk derivatif yang besarnya dapat dicari dengan metoda numerik:
Contoh
penyelesaian soal menghitung laju reaksi dari suatu data konsentrasi dengan menggunakan metode diferensiasi grafis:
100 ml larutan A dengan konsentrasi A 10 gmol/L dalam reaktor bereaksi membentuk B, selama terjadi reaksi diamati konsentrasi A, diperoleh data sebagai berikut :
Tabel Data Konsentrasi A
| Waktu (menit) | CA(gmol/L) |
| 5 | 6,8 |
| 10 | 4,9 |
| 15 | 4,0 |
| 20 | 3,2 |
| 25 | 2,9 |
| 30 | 2,5 |
Bagaimana bentuk persamaan kecepatan reaksinya, tentukan laju reaksi dan konstanta kecepatan reaksinya
Penyelesaian :
Untuk menentukan orde reaksinya, maka dilakukan percobaan terhadap orde reaksi, percobaan pertama terhadap reaksi orde 1 dengan persamaan kecepatan reaksi rA= kCA, maka dapat disusun persamaan hubungan konsentrasi A dengan waktu dalam bentuk derivatif menggunakan neraca massa:
Untuk membuat grafik tersebut diperlukan pegolahan data konsentrasi A dan waktu menjadi sehingga dihasilkan data sebagai berikut :
| Waktu (menit) | CA (gmol/L) | ĉA (gmol/L) | – |
| 5 | 6,8 | ||
| 5,85 | 0,38 | ||
| 10 | 4,9 | ||
| 4,45 | 0,18 | ||
| 15 | 4,0 | ||
| 3,60 | 0,16 | ||
| 20 | 3,2 | ||
| 3,05 | 0,06 | ||
| 25 | 2,9 | ||
| 2,70 | 0,008 | ||
| 30 | 2,5 |
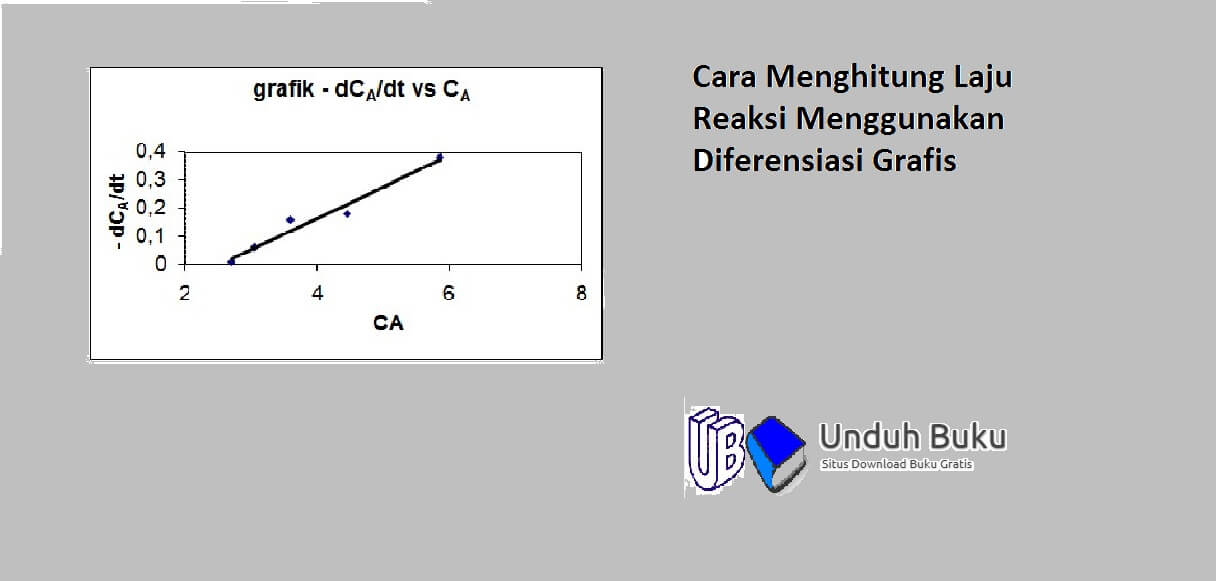
Grafik hubungan
dari grafik tersebut , hubungan mendekati garis lurus maka bisa disimpulkan bahwa reaksi tersebut merupakan reaksi orde satu dengan persaman kecepatan reaksi rA=kCA. Nilai konstanta kecepatan reaksi (k) adalah slope dari garis tersebut k = 0,118 (1/menit) dan nilai laju reaksinya merupakan hasil perkalian nilai konstanta kecepatan reaksi terhadap konsentrasinya.