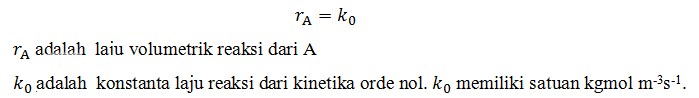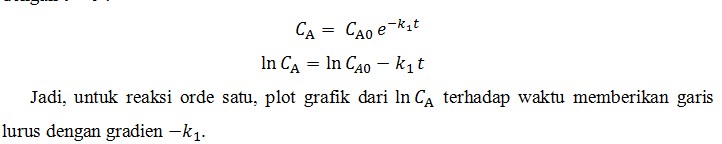Hubungan Kinetik Reaksi
Unduh File Dalam Word Via Google Drive untuk lebih jelas
Download
Kinetika reaksi umum dalam sistem biologi adalah kinetika orde nol, kinetika orde satu, dan kinetika Michaelis-Menten. Michaelis-Menten merupakan kombinasi dari kinetika reaksi orde nol dan kinetika orde satu.
- Kinetika Orde Nol
Reaksi dalam kinetika orde nol, mempunyai laju reaksi yang tidak dipengaruhi oleh konsentrasi reaktan.Berikut adalah persamaannya.
Karena laju volumetrik dari reaksi katalitik tergantung dari jumlah katalis, dimana persamaan di atas dipakai untuk memrepresentasikan laju dari suatu reaksi sel atau enzim, nilai dari k0 termasuk efek dari konsentrasi katalis serta laju spesifik reaksi. Kita dapat menuliskan :
k0‘ adalah konstanta laju spesifik orde 0 untuk reaksi enzimatik dan e adalah konsentrasi dari enzim. Untuk reaksi sel, k0n adalah konstanta laju spesifiknya, dan x adalah konsentrasi dari sel.
Asumsikan kita mempunyai data konsentrasi dari sebuah reaksi, dan kita akan mencari konstanta kinetiknya. Jika reaksi berlangsung dalam sistem tertutup, dan volumenya konstan/tetap, laju reaksi dapat dicari secara langsung sebagai laju perubahan dalam konsentrasi reaktan menggunakan metode diferensiasi grafik. Jika reaksi adalah reaksi orde nol, lajunya akan konstan dan sama dengan k0 sepanjang waktu selama reaksi. Karena ekspresi kinetik dari orde nol relatif simpel, lebih mudah mengintegrasi persamaan 1 dibandingkan mendiferensiasikan dengan untuk memperoleh persamaan untuk sebagai fungsi waktu.
Data percobaan kemudian dapat diperiksa secara langsung terhadap persamaan yang telah di integrasi. Berikut adalah integrasi dari persamaan 1 dengan kondisi awal dengan t = 0 :
Jadi, jika reaksi adalah reaksi orde 0, plot grafik dari terhadap waktu memberikan garis lurus dengan gradien .
- Kinetika Orde Satu
Laju reaksi dalam reaksi kinetika orde satu dipengaruhi oleh konsentrasi reaktan, berikut adalah hubungan antara laju reaksi dan konsentrasi reaktan :
Kita asumsikan suatu reaksi dalam suatu sistem tertutup, dan berada dalam volume konstan, dan kita akan mengukur konsentrasi reaktan A sebagai fungsi waktu. Dibawah kondisi tersebut, . Untuk menentukan apakah reaksi tersebut merupakan kinetika orde satu, pertama-tama kita mengintegrasi persamaan diatas dan lalu melakukan pengecekan terhadap data konsentrasi terhadap persamaan yang dihasilkan. Memisahkan variabel dan mengintegrasi persamaan diatas dengan kondisi awal dengan t = 0 :
Jadi, untuk reaksi orde satu, plot grafik dari terhadap waktu memberikan garis lurus dengan gradien .
- Kinetika Michaelis-Menten
Kinetika dari sebagian besar reaksi enzimatik menggunakan persamaan Michaelis Menten :
Dapat kita lihat dari persamaan diatas, adalah laju volumetrik yang proporsional dengan jumlah enzim. Konstanta Michaelis sebanding dengan konsentrasi saat dimana , nilai untuk beberapa enzim terdapat pada tabel berikut. dan sifat enzim tergantung dari sumber enzim tersebut.
| Enzyme | Source | Substrate | Km (mM) |
| Alcohol dehydrogenase | Saccharomyces cerevisiae | Ethanol | 13,0 |
| α-Amylase | Bacillus stearothermophilus | Starch | 1,0 |
| Porcine pancreas | Starch | 0,4 | |
| β-Amylase | Sweet potato | Amylose | 0,07 |
| Aspartase | Bacillus cadaveris | L-Aspartate | 30,0 |
| β-Galactosidase | Escherichia coli | Lactose | 3,85 |
| Glucose oxidase | Aspergillus niger | D-Glucose | 33,0 |
| Penicillium notatum | D-Glucose | 9,6 | |
| Histidase | Pseudomonas fluorescens | L-Histidine | 8,9 |
| Invertase | Saccharomyces cerevisiae | Sucrose | 9,1 |
| Neurospora crassa | Sucrose | 6,1 | |
| Lactate dehydrogenase | Bacillus subtilis | Lactate | 30,0 |
| Penicillinase | Bacillus licheniformis | Benzylpenicillin | 0,049 |
| Urease | Jack bean | Urea | 10,5 |