Sistem Periodik Unsur – Pengertian, Perkembangan, Sifat – Sifat dan Sistem Penyusunannya – Sejalan dengan perkembangan ilmu pengetahuan dan teknologi, manusia tidak terlepas dari berbagai bentuk masalah dalam kehidupan ,olehnya para ilmuan selalu mengkaji persoalan yang terjadi baik dalam lingkungan maupun alam secara keseluruhan. Dengan hal tersebut sejarah perkembangan yang diangkat lewat latar belakang ini adalah sejarah perkembangan system periodik unsur mulai dari pengelompokkan unsur – unsur yang sederhana hingga pengelompokkan yang secara modern. Sistem priodik merupakan suatu cara untuk mengelompokkan unsur-unsur berdasarkan sifatnya. Pengelompokkan unsur mengalami sejarah perkembangan, sifat logam, non logam, hukum-hukum, golongan, peride, dan sifat-sifat unsur dalam system periodik modern.
Tabel periodik adalah tampilan unsur-unsur kimia dalam bentuk tabel. Unsur-unsur tersebut disusun berdasarkan nomor atom (jumlah proton dalam inti atom), konfigurasi elektron, dan keberulangan sifat kimia. Tabel juga terbagi menjadi empat blok: blok -s, -p, -d, dan -f. Secara umum, dalam satu periode (baris), di sebelah kiri bersifat logam, dan di sebelah kanan bersifat non-logam.
Simak Juga : Soal Sistem Periodik Unsur (SPU) Pilihan Ganda
A. Pengertian Sistem Periodik Unsur
Sistem periodik unsur merupakan susunan unsur-unsur berdasarkan urutan nomor atom dan kemiripan sifat unsur-unsur tersebut. Disebut “periodik”, sebagaimana terdapat pola kemiripan sifat unsur dalam susunan tersebut.
Sistem periodik mengandung banyak informasi tentang sifat-sifat unsur. Selain nomor atom dan nomor massa, banyak tabel periodik yang mencantumkan data titik cair dan titik didih, wujud pada suhu kamar, serta sifat logam dan non logam. Kita akan membahas beberapa sifat tersebut.
Logam dan Nonlogam
Unsur dapat digolongkan ke dalam logam dan nonlogam. Perbandingan sifat antara logam dan nonlogam secara ringkas diberikan pada tabel dibawah ini. Besi, aluminium, emas, dan raksa tergolong logam. Sedangkan hydrogen, oksigen, dan belerang tergolong nonlogam.
| Logam | Nonlogam |
| 1. Kecuali raksa, berwujud padat pada suhu kamar | 1. Ada berwujud padat, cair atau gas. |
| 2. Dapat ditempa dan dapat diregang | 2. Bersifat rapuh, tidak dapat ditempa |
| 3. Mengkilap jika digosok | 3. Kecuali intan (karbon), tidak mengkilap jika digosok |
| 4. Konduktor listrik dan panas | 4. Nonkonduktor, kecuali grafit (karbon) |
Dalam tabel periodik, logam terdapat pada bagian kiri bawah, sedangkan nonlogam pada bagian kanan atas. Artinya sifat logam dalam sistem periodik, makin ke bawah makin besar dan makin ke kanan makin berkurang.
Logam dan nonlogam dibatasi oleh suatu garis tangga di bagian tengah sistem periodik. Unsur-unsur disekitar garis batas tersebut mempunyai dua sifat baik sifat logam maupun sifat nonlogam. Unsur-unsur itu digolongkan sebagai Metaloid.
Titik Leleh dan Titik didih
Bagi unsur logam segolongan, titik leleh dan titik didih makin ke bawah makin rendah. Sedangkan unsur nonlogam segolongan titik leleh dan titik didih makin ke bawah makin tinggi.
Wujud
Wujud zat bergantung pada titik leleh dan titik didihnya. Pada suhu kamar hanya dua unsur yang berwujud cair, 11 unsur berwujud gas dan sisanya berwujud padat.
Kereaktifan
Reaktif artinya mudah bereaksi. Unsur logam pada sistem periodik makin ke bawah makin reaktif, karena makin mudah melepaskan elektron. Sedangkan unsur nonlogam pada sistem periodik makin ke bawah makin kurang reaktif, karena makin sukar menangkap elektron.
Unsur segolongan bukannya mempunyai sifat yang identik, melainkan hanya mirip. Unsur-unsur tersebut mungkin mempunyai sifat yang sama, tetapi kadarnya berbeda. Salah satu sifat unsur logam alkali (golongan IA), yaitu bereaksi dengan air. Akan tetapi, kecepatan reaksinya berbeda, dari atas ke bawah makin dasyat. Satu hal yang harus disadari bahwa setiap unsur mempunyai sifat khas yang membedakannya dari unsur lainnya.
B. Sifat-Sifat Periodik Unsur
Sifat periodik adalah sifat yang berubah secara beraturan sesuai dengan kenaikan nomor atom, yaitu dari kiri ke kanan dalam satu periode, atau dari atas ke bawah dalam satu golongan. Sifat-sifat periodik yang akan dibahas meliputi jari-jari atom, energi ionisasi, afinitas elektron dan kelektronegatifan.
Jari-Jari Atom
Jarak antara inti atom dengan elektron terluar disebut jari-jari atom. Penentuan jari-jari atom, yaitu dengan mengukur jarak antara inti-inti dalam senyawa kovalen menggunakan difraksi sinar-X.
Energi Ionisasi
Energi ionisasi adalah energi yang diperlukan untuk melepaskan elektron terluar dari suatu atom. Apabila suatu atom mempunyai energi ionisasi kecil maka atom tersebut akan mudah melepaskan elektron. Demikian juga sebaliknya, semakin besar energi ionisasi suatu atom akan menyebabkan atom tersebut semakin sukar melepaskan elektron.
Afinitas Elektron
Afinitas elektron adalah besarnya energi yang dilepaskan jika suatu atom menangkap elektron. Afinitas elektron merupakan ukuran mengenai mudah atau tidaknya suatu atom menjadi ion negatif. Apabila atom menangkap elektron, atom bermuatan negatif. Semakin besar energi yang dilepaskan suatu atom, semakin mudah atom-atom tersaebut menangkap elektron.
Keelektronegatifan
Keelektronegatifan adalah kecendrungan suatu atom untuk bermuatan negatif atau kemampuan suatu atom untuk menangkap/menarik elektron dari atom lain. Harga keelektronegatifan ini bersifat relatif antara atom yang satu dengan atom lain.
C. Sejarah Pengelompokan Unsur
Pengelompokan Unsur Menurut Lavoisier
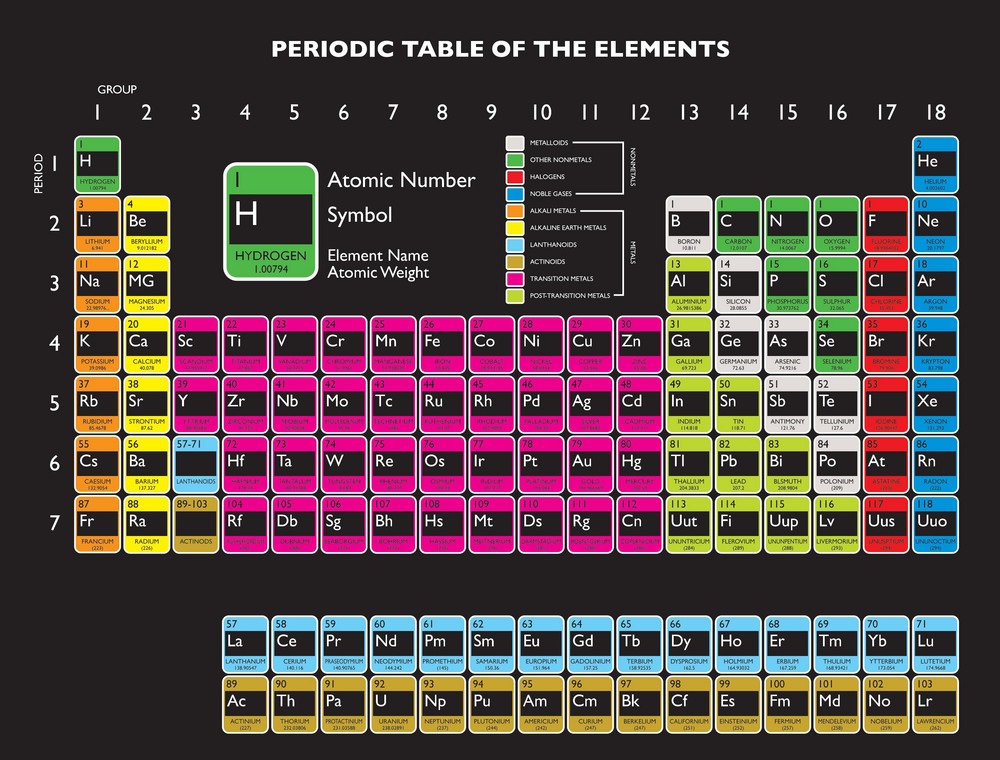
Pada 1789, Antoine Lavoiser mengelompokan 33 unsur kimia. Unsur-unsur kimia di bagi menjadi empat kelompok. Yaitu gas, tanah, logam dan non logam.Unsur gas yang di kelompokan oleh Lavoisier adalah cahaya, kalor, oksigen, azote ( nitrogen ), dan hidrogen. Unsur-unsur yang etrgolong logam adalah sulfur, fosfor, karbon, asam klorida, asam flourida, dan asam borak. Adapun unsur-unsur logam adalah antimon,perak, arsenik, bismuth. Kobalt, tembaga, timah, nesi, mangan, raksa, molibdenum, nikel, emas, platina, tobel, tungsten, dan seng. Adapun yang tergolong unsur tanah adalah kapur, magnesium oksida, barium oksida, aluminium oksida, dan silikon oksida.
- Kelemahan dari teori Lavoisior : Penglompokan masih terlalu umum
- kelebihan dari teori Lavoisior : Sudah mengelompokan 33 unsur yang ada berdasarka sifat kimia sehingga bisa di jadikan referensi bagi ilmuan-ilmuan setelahnya.
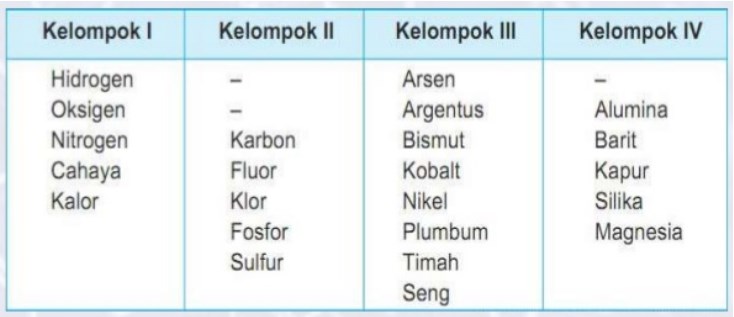
Pengelompokan unsur menurut J.W. Dobereiner
Pada tahun 1829, J.W. Dobereiner seorang profesor kimia dari Jerman mengelompokan unsur-unsur berdasarkan kemiripan sifat-sifatnya.Ia mengemukakan bahwa massa atom relatif strontium sangat dekat dengan masa rata-rata dari dua unsur lain yang mirip dengan strantium, yaitu kalsiium dan barium dan juga mengemukakan beberapa kelompok unsur lain.Dobereiner meyimpulan bahwa unsur-unsur dapat di kelompokan ke dalam kelompok-kelompok tiga unsur yang di sebut triade
- Kelemahan dari teori ini adalah pengelompokan unsur ini kurang efisian dengan adanya beberapa unsur lain dan tidak termasuk dalam kelompok triad padahal sifatnya sama dengan unsur dalam kelompok triefd tersebut.
- Kelebihan dari teori ini adalah adanya keteraturan setiap unsure yang sifatnya mirip massa Atom (Ar) unsure yang kedua (tengah) merupakan massa atom rata-rata di massa atom unsure pertama dan ketiga.
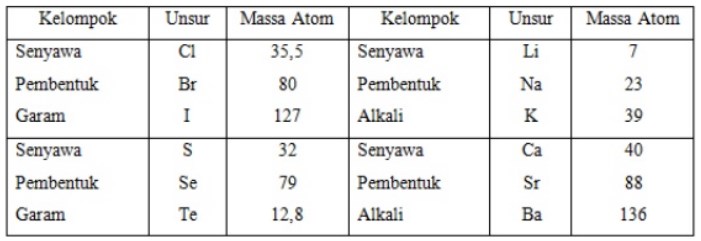
Pengelompokan Unsur Menurut Chancourtois
Pada tahun 1862, ahli geologi Prancis, Alexander Beguyer de Chancourtois, mengelompokkan unsur-unsur kimia berdasarkan kenaikan berat atom. Dia merumuskan bahwa berat atom = 7 + 16n; n = urutan unsur.
Hukum Oktaf Newlands
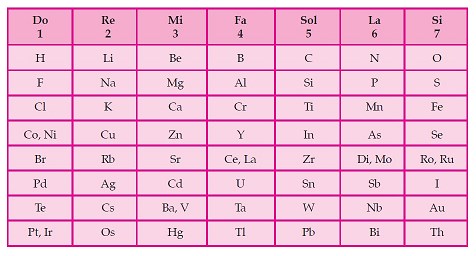
J. Newlands adalah ilmuwan dari Inggris ia merupakan orang pertama yang mengelompokan unsur-unsur berdasarkan kenaikan massa atom relatif. Newlands mengumumkan penemuanya yang di sebut hukum oktaf. Ia menyatakan bahwa sifat-sifat unsur berubah secara teratur. Unsur pertama mirip dengan unsur kedelapan, unsur kedua mirip dengan unsur kesembilan, dan seterusnya. Di sebut hokum Oktaf karena beliau mendapati bahwa sifat-sifat yang sama berulang pada setiap unsur ke delapan dalam susunan selanjutnya dan pola ini menyurapi oktaf music.
- Kelemahan dari teori ini adalah dalam kenyataanya mesih di ketemukan beberapa oktaf yang isinya lebih dari delapan unsur. Dan penggolonganya ini tidak cocok untuk unsur yang massa atomnya sangat besar.
Sistem periodik Mendeleev
Pada tahun 1869 seorang sarjana asal Rusia bernama Dmitri Ivanovich mendeleev, dalam pengamatan 63 unsur yang sudah dikenalnya, menyimpulkan bahwa sifat-sifat unsur adalah fungsi periodik dari massa atom relatifnya. Artinya, jika unsur-unsur disusun menurut kenaikan massa atom relatifnya, maka sifat tertentu akan berulang secara periodik. Mendeleev menempatkan unsur-unsur yang mempunyai kemiripan sifat dalam satu lajur vertikal yang disebut golongan.
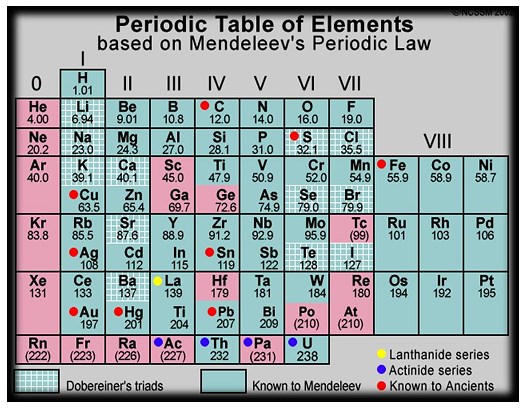
Lajur-lajur horizontal, yaitu lajur unsur-unsur berdasarkan kenaikan massa atom relatifnya, disebut priode daftar periodik Mendeleev yang dipublikasikan tahun 1872. Sebagaimana dapat dilihat pada gambar di atas, Mendeleev mengkosongkan beberapa tempat. Hal itu dilakukan untuk menetapkan kemiripan sifat dalam golongan. Sebagai contoh, Mendelev menempatkan Ti (Ar = 48 ) pada golongan IV dan membiarkan golongan III kosong karena Ti lebih mirip dengan C dan Si, dari pada dengan B dan Al. Mendeleev meramalkan dari sifat unsur yang belum di kenal itu. Perkiraan tersebut didasarkan pada sifat unsurlain yang sudah dikenal, yang letaknya berdampingan baik secara mendatar maupun secara tegak. Ketika unsur yang diramalkan itu ditemukan, teryata sifatnya sangat sesuai dengan ramalan mendeleev. Salah satu contoh adalah germanium ( Ge ) yang ditemukan pada tahun 1886, yang oleh Mendeleev dinamai ekasilikon.
- Kelemahan dari teori ini adalah masih terdapat unsur-unsur yang massanya lebih besar letaknya di depan unsur yang massanya lebih kecil.
- kelebihannya adalah peramalan unsur baru yakni meramalkan unsur beseerta sifat-sifatnya.
Sistem Periodik Modern dari Henry G. Moseley
Pada 1913, seorang kimiawan inggris bernama Henry Moseley melakukan eksperimen pengukuran panjang gelombang unsur menggunakan sinar-X.
Ia menyimpulkan bahwa sifat dasar atom bukan didasari oleh massa atom relative, melainkan berdasarkan kenaikan jumlah proton. Ha tersebut diakibatkan adanya unsur-unsur yang memiliki massa atom berbeda, tetapi memiliki jumlah proton sama atau disebut isotop.
Kenaikan jumlah proton ini mencerminkan kenaikan nonor atom unsur tersebut. Pengelompokan unsur-unsur sisitem periodik modern merupakan penyempurnaan hukum periodik Mendeleev, yang di sebut juga sistem periodik bentuk panjang.
Sistem periodik modern disusun berdasarkan kebaikan nomor atom dan kemiripan sifat. Lajur-lajur horizontal, yang disebut periode disusun berdasarkan kenaikan nomor atom ; sedangkan lajur-lajur vertikal, yang disebut golongan, disusun berdasarkan kemiripan sifat. Sistem periodik modern terdriri atas 7 periode dan 8 golongan. Setiap golongan dibagi lagi menjadi 8 golongan A( IA-VIIIA ) dan 8 golongan B (IB – VIIIB).
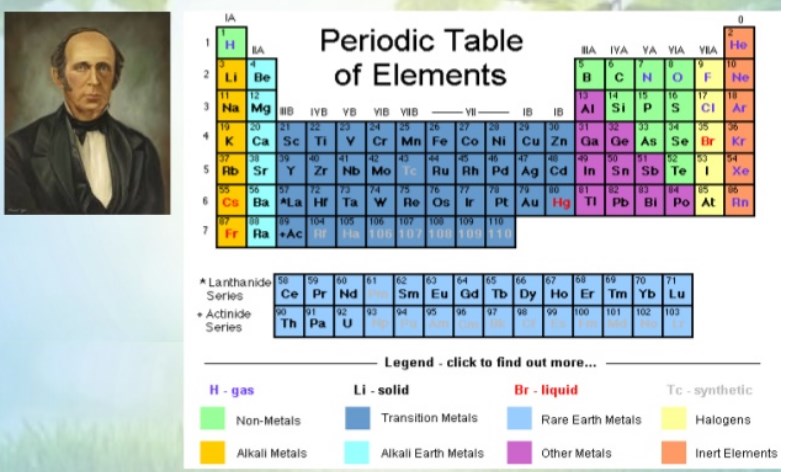
Unsur-unsur golongan A disebut golongan utama, sedangkan golongan B disebut golongan transisi. Golongan-golongan juga dapat ditandai dengn bilangan 1 sampai dengan 18 secara berurutan dari kiri ke kanan. Dengan cara ini maka unsur transisi terletak pada golongan 3 sampai golongan 12. Pada periode 6 dan 7 terdapat masing-masing 14 unsur yang disebut unsur-unsur transisi dalam, yaitu unsur-unsur antanida dan aktinida. Unsur-unsur transisi dalam semua termasuk golongan IIIB. Unsur-unsur lantanida pada periode 6 golongan IIIB, dan unsur-unsur aktinida pada periode 7 golongan IIIB. Penempatan unsur-unsur tersebut di bagian bawah tabel periodik adalah untuk alasan teknis, sehingga daftar tidak terlalu panjang.
Pengelompokan Unsur menurut Seaborg
Pada tahun 1940, Glenn Seaborg berhasil menemukan unsur transuranium yaitu unsur dengan nomor atom 94-102. Ia memecahkan penempatan unsur-unsur tersebut dengan membuat baris baru sehingga tabel periodik modern berubah.
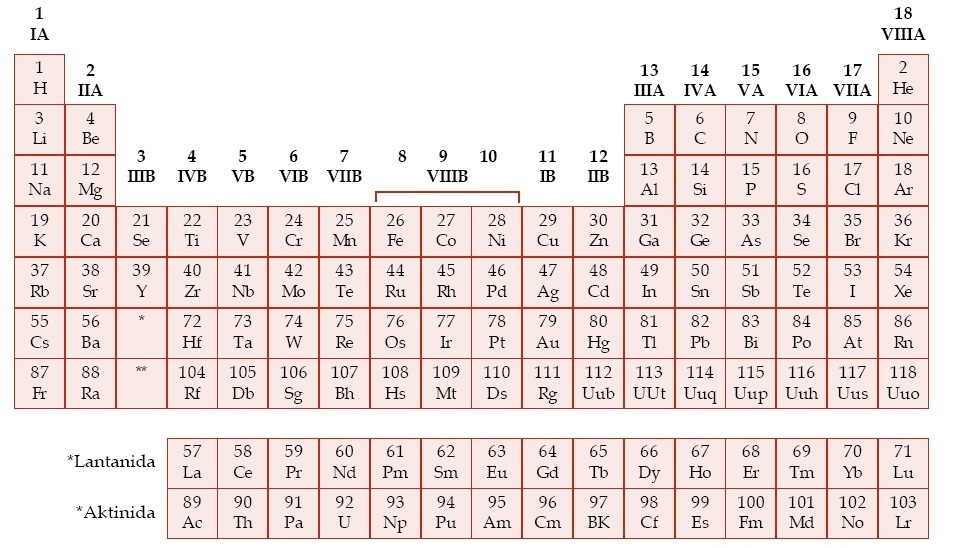
D. Sistem Periodik Modern
Sistem periodik modern disusun berdasarkan hukum periodik modern yang menyatakan bahwa sifat-sifat unsur merupakan fungsi periodik dari nomor atomya. Artinya, jika unsur-unsur disusun berdasarkan kenaikan nomor atomnya, maka sifat-sifat tertentu akan berulang secara periodik. Itu sebabnya tabel unsur-unsur tersebut dinamai Tabel Periodik.
Periode
Lajur-lajur horizontal dalam sistem periodik disebut periode. Sistem periodik modern terdiri atas 7 periode. Jumlah unsur pada setiap periode sebagai berikut.
| Periode | Jumlah Unsur | Nomor Atom |
| 1 | 2 | 1-2 |
| 2 | 8 | 3-10 |
| 3 | 8 | 11-18 |
| 4 | 18 | 19-36 |
| 5 | 18 | 37-54 |
| 6 | 32 | 55-86 |
| 7 | 32 | 87-118 |
Periode 1, 2,3 disebut periode pendek karena berisi relatif sedikit unsur, sedangkan periode 4 dan seterusnya disebut periode panjang.
Golongan
Kolom-kolom vertikal dalam sistem periodik disebut golongan. Penempatan unsur dalam golongan berdasarkan kemiripan sifat. Sistem periodik modern terdiri atas 18 kolom vertikal. Ada dua cara penamaan golongan, yaitu:
- Sistem 8 golongan. Menurut cara ini, sistem periodik dibagi menjadi 8 golongan yang masing-masing terdiri atas golongan utama (golongan A) dan golongan tambahan (golongan B). Unsur-unsur golongan B disebut juga unsur transisi. Nomor golongan ditulis dengan angka Romawi. Golongan-golongan B terletak antara golongan IIA dan IIIA. Golongan VIIIB terdiri atas 3 kolom vertikal.
- Sistem 18 Golongan. Menurut cara ini, sistem periodik dibagi kedalam 18 golongan, yaitu golongan 1 sampai dengan 18, dimulai dari kolom paling kiri. Unsur-unsur transisi terletak pada golongan 3-12
Beberapa golongan unsur dalam sistem periodik mempunyai nama khusus, diantaranya:
- Golongan IA : logam alkali (kecuali hidrogen)
- Golongan IIA : logam alkali tanah
- Golongan VIIA : halogen
- Golongan VIIIA : gas mulia
Unsur transisi dan transisi dalam
- Unsur Transisi
Unsur-unsur yang terletak pada golongan-golongan B disebut unsur transisi atau unsur peralihan. Unsur-unsur tersebut merupakan peralihan dari golongan IIA ke golongan IIIA, yaitu unsur-unsur yang dialihkan hingga ditemukan unsur yang mempunyai kemiripan sifat dengan golongan IIIA
- Unsur transisi dalam
Dua baris unsur yang ditempatkan dibagian bawah Tabel Periodik disebut unsur transisi dalam, yaitu terdiri dari:
- Lantanida, yang beranggotakan nomor atom 57-70 (14 unsur). Ke-14 unsur ini mempunyai sifat yang mirip dengan lantanium (La), sehingga disebut lantanoid atau lantanida
- Aktinida, yang beranggotakan nomor atom 89-102 (14 unsur). Ke-14 unsur ini sangat mirip dengan aktinium, sehingga disebut aktinoida atau aktinida
Semua unsur transisi dalam sebenarnya menempati golongan IIIB, yaitu lantanida pada periode keenam dan aktinida pada periode ketujuh. Jadi, golongan IIIB periode keenam dan periode ke tujuh, masing-masing berisi 15 unsur.
Hubungan Konfigurasi Elektron dengan Sistem Periodik
Hubungan antara letak unsur dalam sistem periodik dengan konfigurasi elektronnya dapat disimpulkan sebagai berikut.
- Nomor periode sama dengan jumlah kulit
- Nomor golongan sama dengan elektron valensi
Berdasarkan hubungan tersebut, maka letak unsur dalam sistem periodik dapat ditentukan berdasarkan konfigurasi elektron.
E. Cara Menentukan Letak Unsur Dalam SPU
Konfigurasi Elektron
| 1. | Unsur dengan nomor atom 11, konfigurasinya : 1s2 2s2 2p6 3s1 – n = 3, berarti periode 3 (kulit M). – elektron valensi (terluar) 3s sebanyak 1 elektron, berarti termasuk golongan IA. |
| 2. | Unsur Ga dengan nomor atom 31, konfigurasinya : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p1 – n = 4, berarti perioda 4 (kulit N). – elektronvalensi 4s2 4p1, berarti golongan IIIA. |
| 3. | Unsur Sc dengan nomor atom 21, konfigurasinya : 1s2 2s2 2p6 3s2 3p6 4s2 3d1 – n = 4, berarti perioda 4 (kulit N). – 3d1 4s2 berarti golongan IIIB. |
| 4. | Unsur Fe dengan nomor atom 26, konfigurasinya : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 – n = 4, berarti perioda 4 (kulit N). – 3d64s2 , berarti golongan VIII. |
Menentukan Elektron Valensi yang menunjukkan Golongan
Elektron yang berada di kulit terluar suatu atom disebut elektron valensi. Elektron valensi suatu unsur menunjukkan golongan unsur tersebut dalam tabel periodik. Elektron valensi paling berperan dalam menentukan sifat kimia unsur. Unsur- unsur dengan jumlah elektron valensi yang sama mempunyai kemiripan sifat kimia. Contohnya seperti berikut:
| Atom Unsur | Konfigurasi elektron | Elektron valensi | Sifat kimia |
| 9F 17Cl | 2 . 7 2 .8 . 7 | 7 7 | Unsur F dan Cl sangat reaktif sehingga di alam hanya ditemukan dalam bentuk senyawanya. |
| 10Ne 18Ar | 2 . 8 2 .8 . 8 | 8 8 | Unsur Ne dan Ar tidak reaktif sehingga di alam berada sebagai unsur monoatom |
Penentuan Golongan dan Periode
Jika jumlah 2 kulit terakhir :
- bila jumlah 2 kulit terakhir < sama dengan 10 = golongan A
- bila jumlah 2 kulit terakhir 11-20 = golongan B (syarat hanya untuk periode ke 4 dstnya)
- bila jumlah 2 kulit terakhir > dari 20 = gol A
Contoh:
No. 1
23X = 2, 8, 8, 3
caranya : 2 kulit terakhir 8 + 3 = 11
maka terletak pada gol IIIB, Periode ke 4
No. 2
17X = 2, 8, 7
caranya : 2 kulit terakhir 8 + 7 = 15
karena periode 3, maka terletak pada golongan VIIA
No. 3
₂₁Sc = 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹
…… 4s² 3d¹ :periode 4 (koefisien terbesar 4) golongan 3B (jumlahkan elektron s dan d)
No. 4
₂₆Fe = 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁶
……4s² 3d ⁶ :periode 4 golongan 8B untuk golongan B, jika berjumlah 3: gol 3B, 4:gol 4B, 5:gol 5B, 6:gol 6B, 7:gol 7B
berjumlah 8,9,10= gol 8B berjumlah 11 = gol 1B berjumlah 12= gol 2B
No. 5
₄₇Ag = 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹° 4p⁶ 5s² 4d⁹
…… 5s² 4d⁹ periode 5 golongan 1B (jumlah elektron pada s dan d = 11)
No. 6
₅₈Ce = 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹° 4p⁶ 5s² 4d¹° 5p⁶ 6s² 4f²
……. 6s² 4f² periode 6 golongan lantanida (4f=Lantanida,5f = Aktinida)
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia



