Contoh Soal Hidrolisis Garam Pilihan Ganda Serta Pembahasannya – Di dalam air, garam dapat terurai menjadi ion-ionnya (terionisasi). Ion-ion itu ada yang bereaksi dengan air, yaitu ion-ion yang berasal dari asam lemah atau basa lemah. Reaksi antara air dengan ion-ion yang berasal dari asam lemah atau basa lemah disebut hidrolisis.
Berikut 45 butir pertanyaan dan penyelesaian terkait materi Hidrolisis Garam beserta kunci jawaban lengkap dengan pembahasannya dari berbagai penerbit buku untuk meningkatkan pemahaman konsep dasar siswa. Selain itu untuk membantu siswa dalam persiapan ulangan ataupun ukk dan UNBK yang akan datang.
Simak Juga Materi : Hidrolisis Garam
1 – 15 Soal Hidrolisis Garam dan Pembahasan
1. pH dari larutan garam NH4CN 0,2M. Diketahui Ka HCN = 4,0 x 10-10 mol/L, Kb NH3 = 1,8 x 10-5 mol/L adalah …..
a. 8,287
b. 8,227
c. 8,872
d. 8,827
(Sumber : Kimia SMA dan MA untuk kelas XI.Esis.Hal : 280)
Pembahasan
Jawaban : D
2. Jika suatu asam kuat dicampur dengan basa lemah, maka akan terbentuk larutan garam yang bersifat . . . .
a. Asam jika Ka > Kb
b. Basa jika Ka < Kb
c. Netral
d. Asam
(Sumber : Kimia SMA dan MA untuk kelas XI.Esis.Hal : 280)
Pembahasan
Sifat larutan garam yang terhidrolisis dapat dikelompokan berdasarkan jenis asam dan basa pembentuknya :
- Garam dari asam kuat dan basa lemah terhidrolisis mebentuk larutan garam yang bersifat asam (pH < 7)
- Garam dari asam lemah dan basa kuat terhidrolisis mebentuk larutan garam yang bersifat basa (pH > 7)
- Garam dari asam lemah dan basa lemah terhidrolisis membentuk larutan garam yang dapat bersifat asam, basa, atau netral.
Juga :
- Larutan garam bersifat asam (pH < 7 ) jika Ka > Kb
- Larutan garam bersifat basa (pH > 7 ) jika Ka < Kb
- Larutan garam bersifat netral (pH = 7) jika Ka = Kb
Jawaban : D
3. Larutan garam yang berasal dari asam lemah dan basa lemah akan bersifat asam, jika . . . .
a. Ka > Kb
b. Ka < Kb
c. Kb > Ka
d. Ka = Kb
(Sumber : Kimia SMA dan MA untuk kelas XI.Esis.Hal : 285)
Pembahasan
Garam dari asam lemah dan basa lemah terhidrolisis membentuk larutan garam yang dapat bersifat asam, basa, atau netral.
- Larutan garam bersifat asam (pH < 7 ) jika Ka > Kb
- Larutan garam bersifat basa (pH > 7 ) jika Ka < Kb
- Larutan garam bersifat netral (pH = 7) jika Ka = Kb
Opsi A : Ka > Kb (Asam)
Opsi B : Ka < Kb (Basa)
Opsi C : Kb > Ka (Basa)
Opsi D : Ka = Kb (Netral)
Jawaban : A
4. pH dari larutan garam NH4Cl 0,2 M jika diketahui Kb NH3 = 1,8 x 10-5 mol/L adalah . . . .
a. 4,74
b. 4,82
c. 4,98
d. 5,26
(Sumber : Kimia SMA dan MA untuk kelas XI.Esis.Hal : 285)
Pembahasan
Jawaban : C
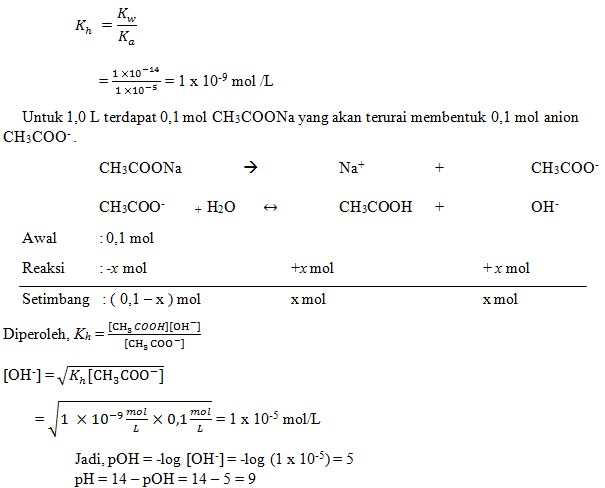
5. Jika Ka (CH3COOH) = 1 X 10-5 maka pH larutan CH3COONa 0,1 M adalah . .
a. 3
b. 9
c. 11
d. 7
e. 13
(SUMBER : Mudah dan Aktif Belajar Kimia. Yayan sunarya. Hal : 202)
Pembahasan :
Jawaban : B
Baca Juga : Soal Larutan Penyangga
6. Jika Kb (NH3) = 1 x 10-5, pH larutan NH4Cl 0,1 M adalah . . . . .
a. 3
b. 9
c. 5
d. 7
e. 13
(SUMBER : Mudah dan Aktif Belajar Kimia. Yayan sunarya. Hal : 202)
Pembahasan
Jawaban : C
7. Jika 5,35 g NH4Cl ( Mr = 53,5 ) dilarutkan dalam air hingga volumenya menjadi 250 mL, akan diperoleh larutan dengan pH . . . .
(Kb NH3 = 1x 10-5)
a. 5 – log 2
b. 9 – log 4
c. 5
d. 5 + log 4
e. 9 – log 4
(SUMBER : KIMIA 2. Nana Sutresna. Hal : 261)
Pembahasan :
Jawaban : A
8. Terdapat 1,0 L larutan garam NH4CH3COO 0,25 M. Diketahui Ka CH3COOH = 1,75 x 10-5 mol/L dan Kb NH3 = 1,8 x 10-5 mol/L berapakah nilai tetapan hidrolisis adalah . . .
a. 5,13 x 10-5 mol/L
b. 4,72 x 10-5 mol/L
c. 8,31 x 10-5 mol/L
d. 3,17 x 10-5 mol/L
e. 4,12 x 10-5 mol/L
(SUMBER : Kimia SMA dan MA Jilid 2. Esis. Hal : 280)
Pembahasan
Jawaban : D
9. pH dari larutan (NH4)2SO4 0,1 M dengan nilai Kb NH3 = 1 x 10-5 adalah . . .
a. 8,85
b. 6,23
c. 3,88
d. 4,73
e. 4,85
(SUMBER : Kimia. Anis Wardani, Nur Hidayati, Shidiq Premono. Hal : 207)
Pembahasan
Jawaban : E
10. pH dari larutan yang terbentuk pada hidrolisis garam NaCN 0,01 M, jika diketahui Ka HCN = 1 x 10-10 adalah . . . .
a. 9
b. 10
c. 11
d. 12
e. 13
(SUMBER : Kimia. Anis Wardani, Nur Hidayati, Shidiq Premono. Hal : 209)
Pembahasan
Jawaban : C
Baca Juga : Soal Asam Basa
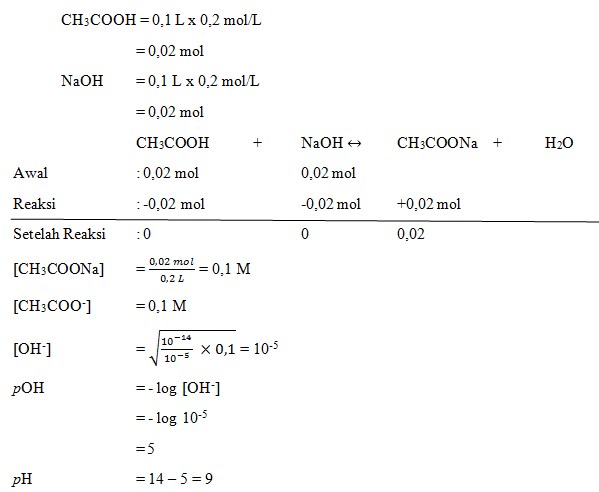
11. pH dari larutan yang merupakan campuran dari 100mL CH3COOH 0,2 M dan 100 ml NaOH 0,2 M , jika Ka CH3COOH = 10-5 adalah ….
a. 9
b. 8
c. 7
d. 10
e. 11
(SUMBER : Kimia. Erlangga. Unggul Sudarmo. Hal : 241)
Pembahasan
Jawaban : A
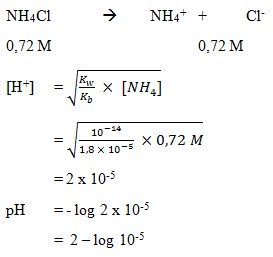
12. Larutan garam NH4Cl 0,72 M mempunyai pH sebesar . . . . . ( Kb = 1,8 x 10-5)
a. 2 – log 5
b. 3 – log 3,6
c. 5 – log 2
d. 9 – log 2
e. 11 + log 3,6
(SUMBER :Kimia dan Kecakapan Hidup. Genesha. 2007. Hal : 266)
Pembahasan
Jawaban : A
13. Sebanyak 4,1 gram garam LX dilarutkan ke dalam air sehingga volume larutan 500 cm3. Jika pH larutan 9 dan Ka = 10-5 maka masa molekul relatif garam LX adalah . . . .
a. 820
b. 205
c. 125
d. 82
e. 76
(SUMBER : Sains KIMIA. BUMI AKSARA. Hal : 244)
Pembahasan
pH = 14 – pOH
9 = 14 – pOH
pOH = 14 – 9 = 5
pOH = – log [OH–]
5 = – log [OH–]
= – log 10-5
Jadi didapat hasil kosentrasi OH– = 10-5
Jawaban : D
14. Dilarutkan 0,98 gram NaCN sampai volume 125 mL, pH larutan adalah. . . .
(Ka HCN = 4 x 10-10, Ar Na = 23, C = 12, N = 14)
a. 2 – log 3
b. 3 – log 2
c. 12 + log 3
d. 11 – log 2
e. 11 + log 2
(SUMBER : Sains KIMIA. BUMI AKSARA. Hal : 244)
Pembahasan
Jawaban : D
15. Jika 2 L larutan CH3COONa memiliki pH = 8 Ka CH3COOH = 10-5 dan Mr CH3COONa = 82, jumlah garam yang terlarut adalah . . . .
a. 82 mg
b. 41 mg
c. 164 mg
d. 246 mg
e. 328 mg
(SUMBER : Chemistry 2B. Nana Sutresna. Hal 213)
Pembahasan
pH = 14 – pOH
8 = 14 – pOH
pOH = 14 – 8 = 6
pOH = – log [OH–]
6 = – log [OH–]
= – log 10-6
Jadi didapat hasil kosentrasi OH– = 10-6

Jawaban : C
16 – 30 Soal Hidrolisis Garam Serta Pembahasan
16. Sebanyak 100 ml larutan CH3COOH 0,2 M dicampurkan dengan 100 ml larutan NaOH 0,2 M. Jika Ka = 10 -5 maka pH larutan setelah dicampurkan adalah…
a. 2
b. 4
c. 5
d. 6
e. 9
( Kimia SMA XI, Unggul Sudarmo, Erlangga, 2013, h. 248 )
Penyelesaian :

pOH = – log [OH–]
= – log 10-5
= 5
pH = 14 – pOH
= 14 – 5
= 9
Jawaban : E
17. Dua jenis larutan yaitu 25 ml NaOH 0,5 M dan 25 ml CH3COOH 0,5 M dicampur menjadi satu. Jika Ka CH3COOH = 10-5, ph larutan campuran adalah …
a. 8 – log 1,58
b. 8 + log 1,58
c. 9 – log 1,58
d. 9 + log 1,58
e. 10 + log 1,58
( Kimia SMA XI, Waldjinah,Anis Dyah Rufaidah,Erna Tri Wulandari, Intan Pariwara, 2012, h. 59 )
Jawaban : D
Penyelesaian :

pOH = 5 – log 1,58
pH = 14 – ( 5 – log 1,58 )
= 9 + log 1,58
18. Larutan NaOH 0,30 M sebanyak 20 ml ditambahkan kedalam 40 ml larutan CH3COOH 0,15 M (Ka = 10-5). Harga pH larutan campuran adalah…
a. 7,0
b. 7,5
c. 8,0
d. 8,5
e. 9,0
( Kimia SMA XI, Waldjinah,Anis Dyah Rufaidah,Erna Tri Wulandari, Intan Pariwara, 2012, h. 59 )
Jawaban : E
Penyelesaian :

pOH = – log 10-5
= 5
pH = 14 – 5
= 9
19. Sebanyak 50 ml larutan HCl 0,1 M dicampurkan dengan 50 ml larutan NH4OH 0,1 M. Jika Kb = 5 x 10-5, pH larutan campuran adalah..
a. 4,0
b. 5,0
c. 5,5
d. 6,0
e. 7,0
( Kimia SMA XI, Waldjinah,Anis Dyah Rufaidah,Erna Tri Wulandari, Intan Pariwara, 2012, h. 59 )
Jawaban : C
Penyelesaian :
20. Larutan KCN dalam air akan bersifat basa, reaksi yang menunjukkan terjadinya sifat basa tersebut adalah…
a. K+ + OH– → KOH
b. CN– + H+ → HCN
c. K+ + H2O → KOH + H+
d. CN– + KOH → KCN + OH–
e. CN– + H2O → HCN + OH–
( Kimia SMA XI, Unggul Sudarmo, Phibeta, 2006, h. 204 )
Jawaban : E
Pembahasan :
Karena Hidrolisis yang berasal dari asam lemah menghasilkan ion OH– . akibatnya kosentrasi ion OH– menjadi lebih tinggi dibandingkan konsentrasi ion H+.
Dengan demikian, larutan garam tersebut bersifat basa dan memiliki pH > 7.
Baca Juga : Soal Ikatan Kimia
21. Diantara garam-garam berikut yang mengalami hidrolisis total dalam air adalah…
a. NH4Cl
b. NH4CN
c. KCN
d. CuSO4
e. MgSO4
( Kimia SMA XI, Unggul Sudarmo, Phibeta, 2006, h. 205 )
Jawaban : B
Pembahasan :
Hidrolisis yang berasal dari asam lemah dan basa lemah merupakan hidrolisis total, sebab kedua ion garam mengalami reaksi hidrolisis dengan air.
Dari soal diatas penyusun dari garam NH4CN adalah NH4OH ( basa lemah ) dan HCN ( asam lemah ) Dan akan terjadi hidrolisis total. Maka NH4CN akan terionisasi menjadi NH4+ dan CN– .
NH4CN → NH4+ + CN–
kedua ion tersebut dapat terhidrolisis dengan reaksi berikut :
NH4+ + H2O → NH4OH + H+
CN– + H2O → HCN + OH–
Oleh karena dihasilkan ion H+ dan OH– maka sifat larutan ditentukan oleh nilai tetapan kesetimbangan dari kedua reaksi tersebut.
22. Garam yang mengalami hidrolisis sebagian dan bersifat asam adalah..
a. CH3COONa
b. HCOOK
c. NH4Cl
d. KCl
e. CH3COONH4
( Kimia SMA XI, Unggul Sudarmo, Erlangga, 2013, h. 251 )
Jawaban : C
Pembahasan :
Garam yang berasal dari asam kuat dan basa lemah yaitu contohnya NH4Cl jika dilarutkan dalam air akan menghasilkan kation yang berasal dari basa lemah, kation tersebut bereaksi dengan air dan menghasilkan ion H+ yang menyebabkan larutan bersifat asam.
NH4Cl → NH4+ + Cl–
Ion NH4+ bereaksi dengan air membentuk reaksi kesetimbangan :
NH4+ + H2O ↔ NH4OH + H+
Adanya ion H+ yang dihasilkan reaksi tersebut mengakibatkan konsentrasi ion H+ didalam air lebih banyak dibandingkan dengan konsentrasi ion OH– sehingga larutan bersifat asam.
Dari kedua ion yang dihasilkan oleh garam tersebut hanya ion NH4+ yang mengalami hidrolisis, sedangkan Cl– tidak bereaksi dengan air.
Jika dianggap bereaksi maka HCl yang terbentuk akan segera terionisasi menghasilkan ion Cl– kembali.
Oleh karena itu hidrolisis ini disebut hidrolisis sebagian karena hanya sebagian ion yang mengalami hidrolisis. Jadi garam yang berasal dari asam lemah dan basa lemah akan terhidrolisis sebagian.
23. Jika tetapan asam CH3COOH = 10-5 maka pH larutan CH3COONa 0,01 M .
a. 7,0
b. 7,5
c. 8,0
d. 8,5
e. 9,0
Jawaban : D
Penyelesaian :
CH3COONa adalah garam yang bersifat basa karena berasal dari CH3COOH ( asam lemah ) dan NaOH ( basa kuat ).
Maka :

24. Jika 10,7 gram NH4Cl (Mr = 53,5 ) dilarutkan dalam air volume 500 ml maka akan diperoleh larutan dengan pH sebesar… (diketahui Kb NH3 = 10-5 )
a. 5 – log 2
b. 5
c. 5 + log 2
d. 9 – log 2
e. 9
( Jalan Pintas Kimia Pintar, Sumarjono, Andi Yogyakarta, 2010, h. 133)
Jawaban : A
Penyelesaian :
NH4Cl adalah garam yang bersifat asam karena berasal dari NH4OH ( basa lemah ) dan HCl (asam kuat ).
Maka :

25. Massa CH3COONa (Mr = 82 ) yang terlarut dalam 10 ml larutan CH3COONa pH = 9 adalah…
a. 8,20 gram
b. 4,10 gram
c. 2,05 gram
d. 0,082 gram
e. 0,041 gram
( Jalan Pintas Kimia Pintar, Sumarjono, Andi Yogyakarta, 2010, h. 133)
Jawaban : D
Penyelesaian :
CH3COONa adalah garam yang bersifat basa karena berasal dari CH3COOH ( asam lemah ) dan NaOH ( basa kuat )
Maka :
pH = 9
pOH = 14 – pH
= 14 – 9
= 5

Baca Juga : Soal Larutan Elektrolit dan Non Elektrolit
26. Di antara campuran berikut ini, yang tidak dapat membentuk garam terhidrolisi adalah…
a. 100 ml CH3COOH 0,1 M + 100 ml NaOH
b. 100 ml HF 0,1 M + 100 ml KOH 0,1 M
c. 100 ml HCl 0,1 M + 100 ml NaOH 0,1 M
d. 100 ml HCl 0,1 M + 100 ml NH4OH 0,1 M
e. 100 ml HCOOH 0,1 M + 100 ml KOH 0,1 M
( Chemistry 2B, Nana Sutresna, Facil, 2010, h. 152 )
Jawaban : C
Pembahasan :
Ion – ion yang dihasilkan dari ionisasi garam yang berasal dari asam kuat dan basa kuat tidak ada yang bereaksi dengan air, sebab jika dianggap bereaksi maka akan segera terionisasi kembali secara sempurna membentuk ion-ion semula.
Jadi, HCl (asam kuat) dan NaOH (basa kuat) konsentrasi ion H+ dan ion OH– dalam air tidak akan terganggu, sehingga larutan bersifat netral.
27. Dari beberapa larutan berikut ini yang terhidrolisis sempurna adalah….
a. CH3COONa
b. CH3COONH4
c. NaCl
d. NH4Cl
e. NaCN
(Chemistry 2B, Nana Sutresna, Facil, 2010, h. 151 )
Jawaban : B
Penyelesaian :
Hidrolisis sempurna terjadi pada garam yang berasal asam lemah dan basa lemah.
CH3COO NH4 berasal dari CH3COOH (asam lemah) dan NH4OH (basa lemah)
28. Larutan garam yang mempunyai pH > 7 adalah…
a. KCl
b. NaCN
c. CuSO4
d. NH4Cl
e. K2SO4
( Kimia SMA XI, Unggul Sudarmo, Phibeta, 2006, h. 204 )
Jawaban : B
Pembahasan :
Garam yang berasal dari asam lemah dan basa kuat maka larutan akan bersifat basa, pH nya > 7. NaOH (basa kuat) sedangkan HCN (asam lemah).
29. Perhatikan persamaan reaksi berikut!
- (1) CH3COO− + H2O ⇌ CH3COOH + OH−
- (2) CN− + H2O ⇌ HCN + OH−
- (3) Al3+ + 3H2O ⇌ Al(OH)3 + 3H+
- (4) NH4+ + H2O ⇌ NH4OH + H+
- (5) S2− + 2H2O ⇌ H2S + 2OH−
Pasangan reaksi hidrolisis untuk garam yang bersifat asam adalah ….
a. 1 dan 2
b. 1 dan 3
c. 2 dan 3
d. 3 dan 4
e. 4 dan 5
( Kimia SMA XI, Unggul Sudarmo, Erlangga, 2013, h. 250 )
Jawaban : D
Pembahasan :
Reaksi hidrolisis yang bersifat asam pada reaksi di atas ditandai dengan dihasilkannya ion H+. Sedangkan reaksi hidrolisis yang bersifat basa ditandai dengan dihasilkannya ion OH−.
Dengan demikian, reaksi nomor 1, 2, dan 4 adalah reaksi hidrolisis untuk garam yang bersifat basa. Sedangkan reaksi nomor 3 dan 4 merupakan reaksi hidrolisis yang garamnya bersifat asam.
30. Jika Kw air = 10-14 dan Ka HCN = 10-14 maka larutan NaCN 0,01 M dalm air akan mempunyai pH sebesar…
a. 3
b. 4
c. 8
d. 9
e. 10
( Kimia SMA XI, Unggul Sudarmo, Erlangga, 2013, h. 250 )
Jawaban : D
Penyelesaian :
31 – 45 Soal Hidrolisis Garam Pilihan Ganda Beserta Pembahasan
31. Berikut ini adalah uji kelarutan sifat asam/basa dari beberapa garam.
| No | Rumus Garam | Uji Lakmus | |
| Merah | Biru | ||
| 1 | NaCl | Merah | Biru |
| 2 | CH3COONa | Biru | Biru |
| 3 | NH4Cl | Merah | Merah |
| 4 | Na2SO4 | Biru | Biru |
| 5 | NaCN | Merah | Biru |
Garam yang mengalami hidrolisis dan sesuai dengan hasil uji lakmusnya adalah ….
a. (1), (2) dan (3)
b. (1), (2) dan (4)
c. (2), (3) dan (4)
d. (2), (3) dan (5)
e. (3), (4) dan (5)
( Sains Kimia SMA/MA Kelas XI.Sri Rahayu Ningsih dkk.Bumi Aksara.2002.hal:244)
Jawaban : A
Pembahasan :
NaCl terbentuk atas basa kuat dan asam kuat. Larutan garam ini bersifat netral dan ketika uji lakmus, maka lakmus merah tetap merah dan lakmus biru tetap biru
CH3COONa terbentuk atas basa kuat dan asam lemah. Larutan ini garam bersifat basa dan ketika uji lakmus maka lakmus merah menjadi biru dan lakmus biru tetap biru
NH4Cl terbentuk atas basa lemah dan asam kuat. Larutan garam ini bersifat asam dan ketika uji lakmus maka lakmus merah tetap merah dan lakmus biru menjadi merah
(Sains Kimia SMA/MA Kelas XI.Sri Rahayu Ningsih dkk.Bumi Aksara.2002.hal:220)
32. Kelompok garam yang mengalami hidrolisis anionnya adalah …
a. NaCN, CH3COONa, NaHCO3
b. NaCl, NH4Cl, ZnCl2
c. NaHCO3, ZnCl2, NH4Cl
d. NH4Cl, MgCl2, NaCN
e. CH3COONa, NaCl, NH4Cl
(Sains Kimia SMA/MA Kelas XI.Sri Rahayu Ningsih dkk.Bumi Aksara.2002.hal:244)
Jawaban : B
Pembahasan :
Garam merupakan senyawa ion yang terdiri dari kation logam dan anion sisa asam. Kation garam dapat dianggap berasal dari suatu basa, sedangkan anionnya berasal dari suatu asam. Jadi setiap garam mempunyai komponen basa (kation) dan asam (anion).
- NaCl ⇌ Na+ kation (aq) + Cl-anion(aq)
- NH4Cl ⇌ NH4+ (aq) + Cl–
- ZnCl2 ⇌ Zn + 2Cl–
(Sains Kimia SMA/MA Kelas XI.Sri Rahayu Ningsih dkk.Bumi Aksara.2002.hal:221)
33. Pasangan senyawa berikut yang mengalami hidrolisis total adalah …
a. NH4Cl dan AlCl3
b. NH4CN dan Al2(SO4)3
c. CaCN dan CH3COONa
d. Na2CO3 dan ZnCl2
e. CH3COONH4 dan NH4CN
( Sains Kimia SMA/MA Kelas XI.Sri Rahayu Ningsih dkk.Bumi Aksara.2002.hal:244)
Jawaban : E
Pembahasan :
Garam yang berasal dari asam lemah dan basa lemah mengalami hidrolisis total dan dikatakan terhidrolisis sempurna
CH3COONH4(aq) → CH3COO–(aq) + NH4+(aq)
H2O(l) ⇌ H+(aq) + OH–(aq)
Karena CH3COOH asam lemah maka ion CH3COO– dari garam beraksi dengan ion H+ dari air. Demikian juga, karena NH3 basa lemah maka ion NH4+ dari garam bereaksi dengan ion OH– dari air reaksinya sbb:
CH3COO–(aq) + H+(aq) ⇌ CH3COOH(aq)
NH4+(aq) + OH–(aq) ⇌ NH4OH(aq)
NH4CN(aq) → NH4+(aq) + CN–(aq)
Ion NH4+ bereaksi dengan air membentuk reaksi kesetimbangan. Hidrolisis garam yang berasal dari asam lemah merupakan hidrolisis total, sebab kedua ion garam mengalami reaksi hidrolisis dengan air.
( Sains Kimia SMA/MA Kelas XI.Sri Rahayu Ningsih dkk.Bumi Aksara.2002.hal:227)
34. Ke dalam 250 ml air dilarutkan 5,35 gram NH4 Jika harga Kb NH4OH adalah 1,8 x 10-5, Hitung pH larutannya …(Mr NH4Cl=35,5)
a. 4,5
b. 5,5
c. 4,8
d. 5,8
e. 6,8
Jawaban : C
Pembahasan :
NH4Cl adalah garam yang berasal dari asam kuat dan basa lemah.
[NH4Cl] = x = 0,4 M

Jawaban : C
( Sains Kimia SMA/MA Kelas XI.Sri Rahayu Ningsih dkk.Bumi Aksara.2002.hal:244)
35. Berapa gram NH4Br harus dilarutkan dalam 500 ml larutan untuk mendapatkan larutan dengan pH = 5- log 2 … ( Kb NH4OH = 1,8 x 10-5, Ar N = 14, H = 1 Br = 80)
a. 24,5 gram
b. 35,3 gram
c. 24,2 gram
d. 37,4 gram
e. 45,7 gram
Jawaban : B
Pembahasan :
Jadi massa NH4Br yang di larutkan adalah 35,3 gram
Jawaban : B
( Sains Kimia SMA/MA Kelas XI.Sri Rahayu Ningsih dkk.Bumi Aksara.2002.hal:244)
Baca Juga : Soal Karbohidrat
36. Air akan berubah pHnya menjadi lebih kecil dari 7, jika kedalam air di larutkan garam …
a. NaCN
b. NH4Cl
c. CH3COONa
d. NaCl
e. K2SO4
(Kimia 2.Sandri Justiana dkk.Yudhistira.2009.hal:215)
Jawaban : B
Pembahasan
Air akan berubah pHnya menjadi lebih kecil dari 7, jika kedalam air di larutkan garam NH4Cl karena garam ini terbentuk dari basa lemah dan asam kuat.
Dalam air garam akan terionisasi sbb:
NH4Cl(aq) → NH4+(aq) + Cl–(aq)
H2O(l) ⇌ H+(aq) + OH–(aq)
10-7 10-7
Karena NH3(aq) basa lemah maka maka ion NH4+ dari garam bereaksi dengan ion OH– dari air, reaksi sbb:
NH4+(aq) + OH–(aq) ⇌ NH3(aq) + NH3(aq)
Karena HCl asam kuat maka ion H+ tidak bereaksi dengan ion Cl–. Berarti garam NH4Cl hanya mengalami hidrolisis sebagian atau terhidrolisis parsial.
Akibatnya:
- [OH–] berkurang, lebih kecil dari 10-7 karena diikat ion NH4+
- [H+] bertambah, lebih besar dari 10-7 karena kesetimbangan bergeser ke kanan (bergeser kearah yang berkurang)
- pH larutan lebih kecil dari 7
- larutan bersifat asam
( Sains Kimia SMA/MA Kelas XI.Sri Rahayu Ningsih dkk.Bumi Aksara.2002.hal:224)
37. Senyawa yang larutannya dalam air yang tidak mengalami hidrolisis adalah …
a. NH4Cl
b. K2SO4
c. CH3COOK
d. (NH4)2SO4
e. CH3COONH4
Jawaban : B
Pembahasan :
Yang tidak mengalami peristiwa hidrolisis adalah garam yang berasal dari asam kuat dan basa kuat. K2SO4 berasal dari KOH dan H2SO4 yang masing-masing berturut-turut merupakan basa kuat dan asam kuat.
K2SO4 tidak mengalami hidrolisis
K2SO4 → 2K+ + SO4–
K+ + H2O → tidak ada reaksi (basa kuat)
SO42- + H2O → tidak ada reaksi (asam kuat)
Sifat larutan netral
( Kimia 2.Sandri Justiana dkk.Yudhistira.2009.hal:215)
38. Garam dibawah ini yang dilarutkan ke dalam air mengalami hidrolisis, kecuali …
a. CH3COOK
b. (NH4)2SO4
c. CH3COONH4
d. NaCl
e. Al2S3
(Kimia 2.Sandri Justiana dkk.Yudhistira.2009.hal:215)
Jawaban : D
Pembahasan :
NaOH (aq) + Hcl (aq) → NaCl (aq) + H2O (l)
NaCl (aq) → Na+ (aq) + Cl– (aq)
Ion Na+ berasal dari basa kuat dan ion Cl- juga berasal dari asam kuat, jadi kedua ion tersebut merupakan asam dan basa Bronsted-Lowry lemah sehinga keduanya tidak bereaksi dalam air (tidak terhidrolisis).
Oleh karena itu larutan bersifat netral atau pH = 7
( Sains Kimia SMA/MA Kelas XI.Sri Rahayu Ningsih dkk.Bumi Aksara.2002.hal:222)
39. Berapa pH larutan garam CH3COONa 0,1 M … (Ka = 10-5)
a. 7
b. 8
c. 9
d. 10
e. 11
Jawaban : C
Pembahasan
CH3COONa merupakan campuran asam lemah dan basa kuat sehimgga bersifat basa.

( Kimia 2.Sandri Justiana dkk.Yudhistira.2009.hal:215)
40. Berapa pH dari larutan CH3COONH4 0,1 M … (Ka = 10-5, Kb = 10-5)
a. 3
b. 4
c. 5
d. 6
e. 7
Jawaban: E
Pembahasan :
CH3COONH4 merupakan campuran asam lemah dan basa lemah sehingga sifatnya bergantung pada pH

pH 7 berarti larutan CH3COONH4 bersifat netral
( Kimia 2.Sandri Justiana dkk.Yudhistira.2009.hal:215)
Baca Juga : Soal Senyawa Turunan Benzena
41. Diberikan persamaan hidrolisis berikut:
Z–(aq) + H2O(l) HZ(aq) + OH–(aq)
Garam berikut ini yang mengalami hidrolisis seperti persamaan hidrolisis diatas adalah ….
a. NH4Cl
b. NH4CN
c. CaCl2
d. Na2SO4
e. KCN
Jawaban : E
Pembahasan :
Persamaan diatas adalah persamaan hidrolisis dari asam lemah dan basa kuat. Dari data pada soal, garam yang berasal dari basa kuat dan asam lemah adalah KCN.
KCN(aq) + H2O → HCN (aq) + K+ + OH–(aq)
(Kimia untuk kelas XI SMA.Nana Sutresna.Grafindo Media Pratama.2006.hal:254)
42. Jika 5,35 gram NH4Cl (Mr = 53,5) dilarutkan dalam air hingga volumenya menjadi 250 ml, akan diperoleh larutan dengan pH … (Kb NH3 = 1 x 10-5)
a. 5 – log 2
b. 9 – log 4
c. 5
d. 5 + log 4
e. 9 – log 4
Jawaban : A
Pembahasan :
(Kimia untuk kelas XI SMA.Nana Sutresna.Grafindo Media Pratama.2006.hal:254)
43. Diantara garam-garam berikut, yang mengalami hidrolisis sempurna adalah …
a. CH3COONa
b. CH3COONH4
c. NaCl
d. NH4Cl
e. NaCN
(Kimia untuk kelas XI SMA.Nana Sutresna.Grafindo Media Pratama.2006.hal:254)
Jawaban : B
Pembahasan :
Salah satu contoh garam yang berasal dari asam lemah dan basa lemah adalah CH3COONH4 .
Dalam air garam terionisasi sbb:
CH3COONH4(aq) → CH3COO–(aq) + NH4+(aq)
H2O(l) ⇌ H+(aq) + OH–(aq)
Karena CH3COOH asam lemah maka ion CH3COO– dari garam beraksi dengan ion H+ dari air. Demikian juga, karena NH3 basa lemah maka ion NH4+ dari garam bereaksi dengan ion OH– dari air reaksinya sbb:
CH3COO–(aq) + H+(aq) ⇌ CH3COOH(aq)
NH4+(aq) + OH–(aq) ⇌ NH4OH(aq)
Berarti garam CH3COONH4 mengalami hidrolisis total atau terhidrolisis sempurna
44. Garam yang memiliki pH > 7 dalam larutannya adalah …
a. NaCl
b. Na2SO4
c. NH4Cl
d. K2CO3
e. K2SO4
Jawaban : D
Pembahasan :
Garam yang berasal dari asam lemah dan basa kuat maka larutan akan bersifat basa`
2KOH + H2CO3 → K2CO3 + 2H2O
KOH adalah basa kuat sehingga ion K+ tidak bereaksi dengan ion OH–. Berarti garam K2CO3 hanya mengalami hidrolisis sebagian dan disebut mengalami hidrolisis sebagian atau hidrolisis parsial, akibatnya pH larutan lebih besar dari 7
45. Berikut adalah beberapa larutan:
- (1) KNO3
- (2) NH4Cl
- (3) Na2SO4
- (4) Na2CO3
- (5) CH3COOK
Pasangan garam yang bersifat netral ditunjukkan oleh nomor….
a. (1) dan (3)
b. (2) dan (3)
c. (2) dan (4)
d. (3) dan (4)
e. (4) dan (5)
Jawaban : A
Pembahasan :
Garam yang bersifat netral (pH = 7), terbentuk dari pasangan asam kuat + basa kuat.
Dari soal yang termasuk asam dan basa kuat:
| Asam Kuat | Basa Kuat |
| HNO3 | KOH |
| HCl | NaOH |
| H2SO4 |
asam dan basa lemah
| Asam Lemah | Basa lemah |
| H2CO3 | NH4OH |
| CH3COOH |
Terlihat KNO3 dan Na2SO4 terbentuk dari asam kuat dan basa kuat sehingga bersifat netral
Unduh Soal Hidrolisis Garam
Apabila ada yang kurang jelas dari website :
Anda dapat juga mendownload File dalam format .doc agar mudah dibaca dan tertata rapi.
Google Drive | Zippyshare | Mirror
Sudah selesai membaca dan berlatih soal ini ? Ayo lihat dulu Daftar Soal Kimia lainnya


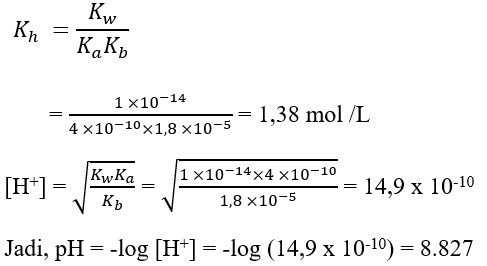



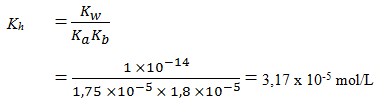
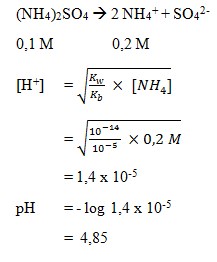
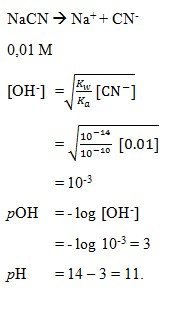
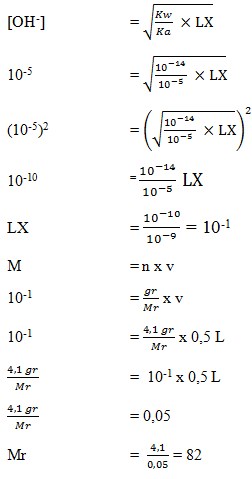
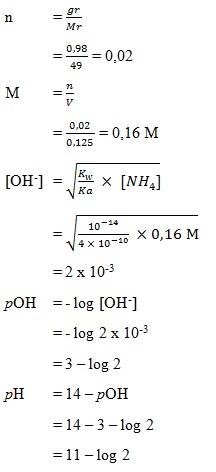





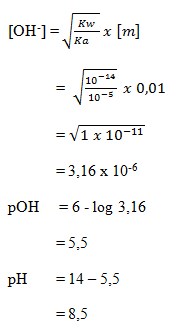
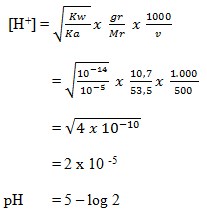
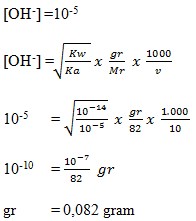
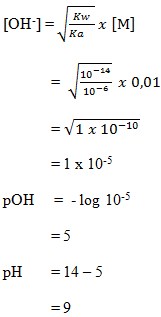
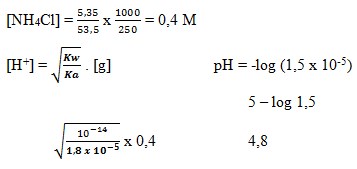
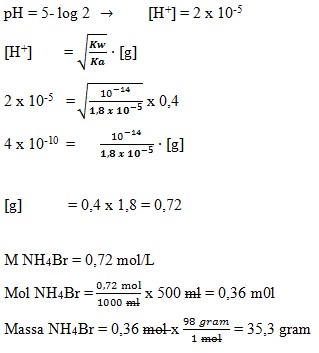
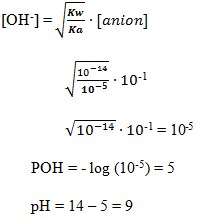




Sangat membantu
terimakasih
maaf saya boleh minta link google drivenya?. Terimakasih
https://drive.google.com/file/d/1GiRisMfUnx0fpATCGwvwltaH9cNb0Z5v/view
Semangat belajarnya ya