Contoh Soal Kesetimbangan Kimia Pilihan Ganda dan Jawaban – Pada dasarnya, istilah kesetimbangan berhubungan dengan apa yang kita sebut ”keseimbangan kimia” akan tetapi, keseimbangan ini merupakan keseimbangan Mekanik. Ketika suatu reaksi kimia berlangsung dalam sebuah bejana yang mencegah masuk atau keluarnya zat-zat yang terlibat dalam reaksi tersebut.

1 – 10 Soal Kesetimbangan Kimia dan Jawaban
1. Suatu sistem reaksi dalam keadaan setimbang bila…
a. Reaksi berlangsung dua arah pada waktu bersamaan
b. Reaksi berlangsung dalam dua arah dalam laju reaksi yang sama
c. Jumlah mol zat yang ada pada keadaan setimbang selalu sama
d. Masing-masing zat yang bereaksi sudah habis
e. Jumlah zat yang terbentuk dalam reaksi sama dengan pereaksi
Pembahasan:
Kesetimbangan dinamis yaitu proses bolak-balik dengan laju yang sama untuk kedua arah. Proses kesetimbangan dinamis ini dapat terjadi pula dalam suatu reaksi kimia.
Jawaban : B
2. Rumusan tetapan kesetimbangan untuk reaksi :
Pembahasan :
Hukum kesetimbangan yaitu bila suatu reaksi dalam keadaan setimbang, mak hasil kali konsentrasi zat-zat hasil reaksi dipangkatkan koefisiennya dibagi dengan hasil kali konsentrasi zat-zat pereaksi dipangkatkan koefisiennya akan mempunyai harga tetap. Jika reaksi itu dalam wujud solid dan liquid maka diabaikan.
Jawaban : E
3. Gas A,B, dan C masing-masing 0,4 mol, 0,6 ,mol, dan 0,2 mol dicampurkan dalam ruang tertutup dan terjadi reaksi kesetimbangan:
Pada saat setimbang 0,3 mol gas A telah bereaksi, maka gas B yang ada dalam keadaan setimbang adalah…
a. 0,5 mol
b. 0,4 mol
c. 0,3 mol
d. 0,2 mol
e. 0,1 mol
Pembahasan :
Dengan menggunakan perbandingan koefisien maka :
Jawaban : A
4. Agar pada reaksi kesetimbangan:
Jumlah gas NO yang dihasilkan maksimal, maka tindakan yang diperlukan adalah…
a. Menaikan tekanan
b. Menurunkan takanan
c. Mengecilkan volum
d. Menaikan suhu
e. Memperbesar volume
Pembahasan :
Menurut Azas Le Chatelier, jika sistem dalam kesetimbangan terjadi kenaikan suhu, maka akan terjadi pergeseran kesetimbangan kearah reaksi yang menyerap kalor (Apabila koefisien sama antara produk dan reaksi maka volume dan tekanan tidak mempengaruhi reaksi.
reaksi diatas termasuk reaksi endoterm jadi jika dinaikkan suhu maka kesetimbangan akan bergeser kearah reaksi endoterm atau bergeser kearah kanan (NO), jika reaksi bergeser kerah kanan maka nilai Kc akan semakin besar.
Jawaban : B
5. Gas N2 dengan volume 10 ml direaksikan dengan 25 ml gas H2, membentuk reaksi setimbang:
Volume akhir pada saat setimbang tercatat 25 ml (diukur pada P dan T yang sama). Volum gas NH3 yang terjadi pada saat setimbang adalah…
a. 5 ml
b. 10 ml
c. 15 ml
d. 35 ml
e. 40 ml
Pembahasan :
Diketahui :
V = 10 ml
Vt = 25 ml
V H2 = 25 ml
Dengan menggunakan perbandingan koefisien maka :
Jawaban : B
Baca Juga : Soal Alkali dan Alkali Tanah
6. Dalam ruang 1 liter terdapat 1 mol gas HI yang terurai menurut reaksi:
Harga Kc pada saat itu adalah 4, jumlah gas H2 yang ada pada saat setimbang adalah…
a. 0,8 mol
b. 0,6 mol
c. 0,5 mol
d. 0,4 mol
e. 0,2 mol
Pembahasan :
Jawaban : D
7. Reaksi yang termasuk kesetimbangan homogen ialah…
Pembahasan:
Kesetimbangan homogen adalah reaksi kesetimbangan yang memiliki fasa reaktan dan produk sama. Pada pilihan
reaksi yang tertera tidak berada dalam satu fasa, pada pereaksi terdapat fasa solid. Jadi pilihan a kurang tepat
terdapat fasa yang berbeda, yaitu ada fase aq dan liquid, jadi bukan jawaban yang tepat .
memiliki fasa yang berbeda
fasanya sama
berbeda fasa
Jawaban : D
8. Perhatikan reaksi berikut.
Reaksi kesetimbangan bergeser kekiri jika…
a. Konsentrasi O2 ditambah
b. Suhu diturunkan
c. Tekanan diperkecil
d. Konsentrasi NO2 dikurangi
e. Volume diperbesar
Pembahasan :
Jika suhu diturunkan reaksi kesetimbangan bergeser ke kiri. Jika suhu dinaikkan reaksi kesetimbangan bergeser kekanan.
Jawaban : B
9. Reaksi kesetimbangan yang bergeser kekanan jika tekanan diperbesar adalah…
Pembahasan :
Jika tekanan diperbesar maka kesetimbangan akan bergeser ke jumlah koefisien zat yang kecil dan bila tekanan di perkecil maka reaksi kesetimbanangan bergeser ke jumlah koefisien zat yang besar.
Pada pilihan diatas :
a. 2HI(g) ↔ H2(g) +I2(g)
Mempunyai koefesien pereaksi 2 dan hasil reaksi 2 = setara
b. N2O4(g) ↔ 2NO2(g)
Koefesien pereaksi nya 1 dan hasil reaksi 2. Jadi kesetimbangan bergeser kerah kiri.
c. CaCO3(s) ↔ CaO(s) + CO2(g)
Koefesien pereaksi 0 karena pada pereaksi terdapat fase solid yang tidak dihitung koefesiennya dan hasil reaksi koefesiennya 1 berarti kesetimbangan bergeser kearah kiri.
d. 2NO(g) + O2(g) ↔ 2NO2(g) = 3 ⇒ 2
Koefesien pereaksi 3 dan hasil reaksi 2 jadi kesetimbangan bergeser kearah kanan
e. S(s) + O2(g) ↔ SO2(g) = 1 ⇒ 1
Koefesien antara pereaksi dan hasil reaksi sama sama 1
Jawaban : D
10. Pada suhu tertentu, dalam ruang 1 liter terdapat kesetimbangan:
Semula terdapat 0,5 mol gas SO3 dan setelah tercapai kesetimbangan perbandingan jumlah mol SO3 terhadap O2 adalah 4:3. Harga tetapan kesetimbangannya adalah…
a. 0,125
b. 0,3375
c. 0,187
d. 0,563
e. 1,687
Pembahasan :
Jawaban : B
11 – 20 Contoh Soal Kesetimbangan Kimia dan Jawaban
11. Perhatikan reaksi kesetimbangan berikut:
Apabila pada volume tetap pada temperatur dinaikkan, keserimbangan bergeser kearah…
a. Kanan dan harga K tetap
b. Kiri dan harga K kecil
c. Kanan dan harga K semakin besar
d. Kanan dan harga K semakin kecil
e. Kiri dan harga K makin besar
Pembahasan:
Kenaikan temperatur menyebabkan kesetimbangan bergeser kekanan, kearah hasil dan harga K naik.
Jawaban : C
12. Suatu reaksi dapat balik dikatakan mencapai keadaan setimbang jika..
a. Harga tetapan kesetimbangan Kc = 1
b. Harga tetapan kesetimbangan Kc = 0
c. Kecepatan reaksi kekanan sama dengan kekiri
d. Jumlah mol zat sebelum dan sesudah reaksi sama
e. Massa zat sebelum dan sesudah reaksi sama
Pembahasan:
Mula-mula reaksi A dan B berkurang dengan cepat, kemudian tidak begitu cepat, dan akhirnya mencapai harga yang tetap. Keadaan sistem yang demikian disebut setimbang.
Jawaban : C
13. Diketahui reaksi :
2A(s) + B(l) → 3C(s) +2D(g)
Pembahasan
Zat-zat pereaksi dipangkatkan koefisiennya akan mempunyai harga tetap. Jika reaksi itu dalam wujud solid dan liquid maka diabaikan.
Jawaban : C
14. Pada suhu tertentu dalam ruang tetutup yang bertekanan 10 atm terdapat dalam keadaan setimbang 0,3 mol gas SO2 ; 0,1 mol gas SO3 ; dan 0,1 mol gas O2 dengan reaksi :
Harga Kp pada suhu tersebut adalah…
a. 36 atm
b. 18 atm
c. 9 atm
d. 4,5 atm
e. 0,05 atm
Pembahasan:
Jawaban : B
15. Suatu sistem kesetimbangan bersifat dinamis-mikroskopis berarti…
a. Perubahan berlangsung terus-menerus dan dapat diamati
b. Reaksi terus berlangsung kekanan dan kekiri dan dapat diamati
c. Reaksi terus berlangsung kekanan dan kekiri tetapi tidak teramati
d. Perubahan berlangsung terus berhenti sehingga tidak dapat diukur
e. Perubahannya terhenti dan dapat terukur
Pembahasan :
Kesetimbangan dinamis yaitu proses bolak-balik dengan laju yang sama untuk kedua arah. Jadi reaksi berlangsung kekanan dan kekiri. Bersifat dinamis-mikroskopis maksunya hanya terjadi sedikit perubahan jadi tidak teramati.
Jawaban : C
Baca Juga : Soal Penyetaraan Reaksi Redoks
16. Berikut adalah faktor-faktor yang mempengaruhi kesetimbangan suatu reaksi reversible, kecuali…
a. Suhu
b. Volume
c. Tekanan
d. Konsentrasi
e. Katalisator
Pembahasan :
Faktor-faktor yang mempengaruhi kesetimbangan yaitu suhu, konsentrasi, tekanan, dan volume.
Jawaban : E
17. Dalam ruangan 1 liter terdapat kesetimbangan antara gas N2, H2 dan NH3 sesuai persamaan reaksi berikut.
Pada kesetimbangan tersebut terdapat 0,01 mol N2, 0,01 mol H2 dan 0,05 mol NH3. Nilai tetapan kesetimbangan reaksi adalah…
a. 2 x 10-8
b. 4 x 10-6
c. 5 x 10-10
d. 2 x 10-10
e. 2 x 10-10
(Advanced Learning Chemistry 2A, Nana Sutresna, Facil, 2010, h 185)
Pembahasan :
Jawaban : B
18. Perhatikan reaksi berikut.
A + B → C + D
Jika satu mol A dicampur dengan satu mol B dan pada kestimbangan terdapat 0,2 mol A, tetapan kesetimbangan reaksi diatas adalah…
a. 0,4
b. 1,6
c. 4
d. 8
e. 16
Pembahasan :
Jawaban : E
19. Pada suhu 750 K terdapat kesetimbangan :
Jika R = 0,08 harga Kp adalah…
a. 1,5 x 10-1
b. 1,6 x 10-2
c. 2,7 x 10-3
d. 7,5 x 10-4
e. 1,25 x 10-5
(OSN Kimia SMA, A. Haris Watoni, Yramawidya, 2014, h 224)
Pembahasan :
Jawaban : E
20. Pada suhu 700 K terjadi reaksi kesetimbangan :
Nilai Kp untuk reaksi tersebut adalah…
a. 0,99
b. 9,99
c. 0,11
d. 11,0
e. 110
(OSN Kimia SMA, A. Haris Watoni, Yramawidya, 2014, h 225)
Jawaban : C
21 – 30 Soal Kesetimbangan Kimia dan Jawaban
21. Tetapan kesetimbangan untuk reaksi kesetimbangan :
2A(g) + B(g) ↔ C(g) + D(g)
Pada suhu tertentu adalah 2,5. Bila reaksi ke arah C dan D adalah eksotermik, maka bila suhu dinaikkan, tetapan kesetimbangan menjadi . . . .
a. Tetap 2,5
b. Kurang dari 2,5
c. Lebih dari 2,5
d. Tidak tentu
e. Tidak dapat diprediksi
(OSN Kimia SMA, A. Haris Watoni, Yramawidya, 2014, h 224)
Pembahasan :
Sesuai dengan azas Le Chatelier “ jika suhu dinaikkan maka reaksi akan bergeser kearah reaksi yang menyerap kalor (reaksi endoterm). Jika suhu diturunkan maka reaksi bergeser kearah reaksi yang melepas kalor (reaksi endoterm)”
“suhu berubah, maka nilai Kc berubah” dimana bila reaksi bergeser kekanan maka nilai Kc makin besar dan jika reaksi bergeser kekiri maka nilai Kc makin kecil
Jawaban : B
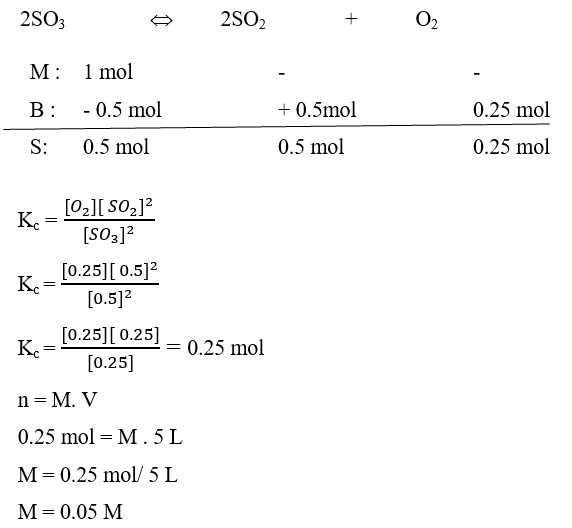
22. Pada peruraian 1 mol gas SO3 menjadi gas SO2 dan O2 dalam ruang bervolume 5 dm³ diperoleh gas O2 sebanyak 0,25 mol, maka harga tetapan kesetimbangan sebesar. . . . M
a. 0,05
b. 0,5
c. 5
d. 10
e. 15
(OSN Kimia SMA, A. Haris Watoni, Yramawidya, 2014, h 224)
Pembahasan :
Diket : V = 5 dm³ = 5 L
SO3 = 1 mol
O2 = 0,25 mol
Dit : Kc
Penyelesaian
Jawaban : A
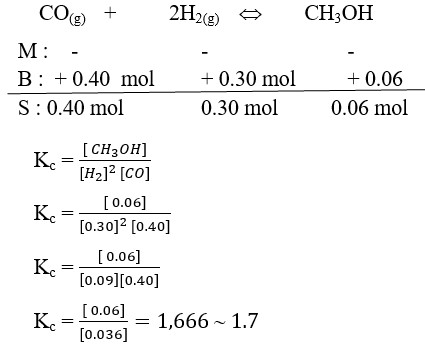
23. Pada temperatur tinggi, bila gas karbon monoksida bereaksi dengan gas hydrogen akan menghasilkan methanol seperti pada persamaan reaksi berikut:
Bila 0.40 mol CO dan 0.30 mol H2 bereaksi dalam bejana 1 L dan mencapai kesetimbangan ternyata terbentuk 0.06 mol CH3OH. Nilai Kc untuk reaksi tersebut adalah . . . .
a. 0.50
b. 0.98
c. 1.7
d. 2.0
e. 5.4
(OSN Kimia SMA, A. Haris Watoni, Yramawidya, 2014, h 227)
Pembahasan :
Jawaban : C
24. Pada ruang tertutup terdapat 1 mol gaas NH3 yang terdisosiasi 50% menurut persamaan reaksi : 2NH3(g) ↔ N2(g) + 3H2(g)
Jika tekanan di dalam ruang tersebut 3 atm, maka harga Kp pada saat itu adalah . . . . .
Pembahasan :
Jawaban : E
25. dalam suatu ruangan 10 liter pada suhu 7°C terdapat dalam keadaan kesetimbangan 1 mol NH3, 2 mol O2, 2 mol NO dan 2 mol uap air menurut persamaan.
Harga tetapan kesetimbangan reaksi pada suhu tersebut adalah . . . . . .
a. 0,25
b. 0,5
c. 3,2
d. 32
e. 64
Pembahasan :
Jawaban : D
Baca Juga : Soal Termokimia
26. Ke dalam ruangan tertutup dimasukan 1 mol gas A dan 1 mol gas B. Setelah bereaksi menurut persamaan 2A + 3B ↔ A2B3 dan dicapai kesetimbangan, masih terdapat 0,25 mol gas B. Kalau volume ruang 1 dm3, maka tetapan kesetimbangan reaksi tersebut ialah . . . . .
a. 16
b. 32
c. 64
d. 72
e. 80
Pembahasan :
Jawaban : C
27. jika terhadap suatu system kesetimbangan dilakukan suatu aksi, pada system akan terjadi suatu reaksi sehingga pengaruh aksi terhadap system menjadi sekecil mungkin. Asas ini dikemukakan oleh . . . . .
a. Van’t Haff
b. de Broglie
c. le Chatelier
d. Hess
e. Dalton
Pembahasan :
Hubungan antara reaksi yang timbul pada system kesetimbangan dengan aksi yang diberikan dari luar dirumuskan oleh seorang ahli kimia berkebangsaan perancis, Henry Louis Le Chatelier, yang tekenal dengan asas Le Chatelier, yang menyatakan:
“Jika pada suatu sistem yang berada dalam keadaan setimbang dilakukan suatu aksi (tindakan), maka system akan mengadakan reaksi yang cenderung mengurangi pengaruh aksi tersebut.”
Jawaban : C
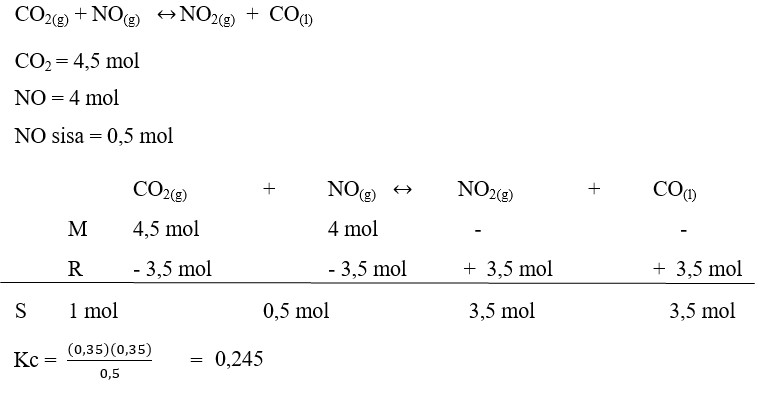
28. Reaksi :
dilakukan dalam wadah 5L, pada keadaan awal terdapat 4,5 mol CO2 dan 4 mol NO. Sesudah kesetimbangan, NO yang masih tersisa 0,5 mol. Tetapan kesetimbangan reaksi tersebut adalah . . . . . .
a. 0,1125
b. 0,245
c. 0,355
d. 0,49
e. 0,06
Pembahasan :
Jawaban : B
29. Kedalam bejana 1 liter dimasukan x mol CO dan X mol uap air. Jika tercapai kesetimbangan :
Ternyata ada ¼ x mol CO2, maka tetapan kesetimbangan Kc, bagi reaksi ini ialah . . . . .
a. 1/4
b. 1/8
c. 1/9
d. 1/16
e. 1/32
Pembahasan :
Jawaban : C
30. Suatu kesetimbangan dikatakan dinamis, apabila dalam kesetimbangan…
a. Reaksi ke kanan dan ke kiri telah terhenti
b. Secara makroskopis reaksi berlangsung terus menerus
c. Laju reaksi ke kanan lebih cepat dari laju reaksi ke kiri
d. Secara mikroskopis reaksi tetap berlangsung kedua arah
e. Jumlah mol zat pereaksi selalu sama dengan jumlah mol hasil reaksi
Jawaban : D
Pembahasan:
Bersifat dinamis artinya secara mikroskopis reaksi berlangsung terus menerus dalam dua arah dengan laju reaksi pembentukan sama dengan laju reaksi baliknya, yang mana dapat dilihat dari perubahan suhu, tekanan, konsentrasi atau warnanya.contohnya pada reaksi berikut :
Bila sejumlah gas N2O4 dimasukkan kedalam botol tertutup, gas yang semula tak berwarna secara perlahan-lahan akan berubah menjadi coklat. Pada awalnya perubahan itu tidak tampak namun secara bertahap akan semakin menjadi coklat, pada suatu saat warna tersebut akan tidak bertambah pekat, pada saat itulah terjadi kesetimbangan.
Pada saat kesetimbangan tersebut masih ada gas N2O4, hal ini dapat dibuktikan dengan mendinginkan tabung tersebut. Pada saat didinginkan warna coklat semakin pucat, ini menunjukkan bahwa gas N2O4 terbentuk lebih banyak. Jadi, pada saat setimbang baik pereaksi maupun hasil reaksi masih tetap ada dalam sistem.
31 – 40 Soal Kesetimbangan Kimia dan Jawaban
31. Pada suhu tertutup yang tekanannya 10 atm, terdapat dalam keadaan setimbang 0,3 mol gas SO2 ; 0,1 mol gas SO3 ; 0,1 mol gas O2 dengan reaksi :
Nilai Kp pada suhu tersebut adalah…
a. 36 atm
b. 18 atm
c. 19 atm
d. 4,5 atm
e. 0,05 atm
Jawaban : B
Pembahasan :
Diket :
tekanan (P) = 10 atm
nSO2 = 0,3 mol
nSO3 = 0,1 mol
nO2 =0,1 mol
Ditanya, Kp ?
32. Pada reaksi kesetimbangan :
PCl5 (g) ↔ PCl3 (g) + HCl (g)
Pada suhu 27°C mempunyai nilai Kc = 0,04. Nilai Kp pada kesetimbangan tersebut adalah..
a. 0,0885
b. 0,0984
c. 0,885
d. 0,984
e. 1,080
(Kimia SMA XI, Unggul Sudarmo, Erlangga, 2013, h. 174)
Jawaban : D
Pembahasan :
33. Dalam ruang 1 liter terdapat kesetimbangan antara gas N2, H2 dan NH3 dengan persamaan reaksi :
2NH3 (g) ↔N2 (g) + 3H2 (g)
Pada kesetimbangan tersebut terdapat dalam 0,01 mol N2 ; 0,01 mol H2 ; 0,05 mol NH3. Nilai tetapan kesetimbangan reaksi adalah..
a. 2 x 10-8
b. 5 x 10-5
c. 5 x 10-10
d. 4 x 10-6
e. 2 x 10-10
Jawaban : D
Pembahasan :
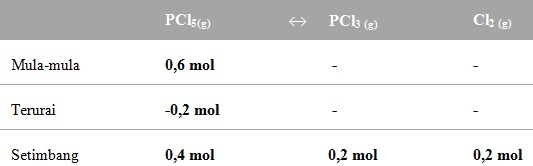
34. Dalam ruang 1 liter sebanyak 0,6 mol gas PCl5 dipanaskan menurut reaksi :
PCl5 (g)↔PCl3 (g) + Cl2 (g)
Dalam kesetimbangan dihasilkan 0,2 mol gas Cl2 jika temperatur pada ruangan 300 K dan harga R = 0,082 , harga Kp adalah…
a. 0,04 atm
b. 0,10 atm
c. 1,64 atm
d. 2,46 atm
e. 6,05 atm
Pembahasan :
Jadi Mencari Kc dan Kpnya
Kp = Kc (RT)Δn
= 0,1 x (0,082 x 300)¹
= 2,46 atm
Jawaban : D
35. Diantara persamaan reaksi kesetimbangan berikut ini akan bergeser ke kanan jika tekanan diperbesar, yaitu . . .
a. S(s) + O2(g)↔ SO2(g)
b. H2(g) + I2(g)↔2HI (g)
c. 2SO3(g)↔ 2SO2(g) + O2(g)
d. C (s) + O2(g)↔ CO2(g)
e. N2(g) + 3H2(g)↔ 2NH3(g)
Jawaban : E
Pembahasan :
Dapat kita lihat bahwa pada persamaan N2(g) + 3H2(g)↔ 2NH3(g) jumlah mol diruas kiri (4) > jumlah mol diruas kanan (2)
Kemudian jika tekanan diperbesar maka volume akan berkurang, reaksi akan bergeser kejumlah mol yang paling kecil yaitu pada ruas kanan. Jadi, reaksi akan bergeser ke arah kanan.
Baca Juga : Soal Hidrolisis Garam
36. Pada T°C dalam ruangan yang bervolume 10 liter dipanaskan 0,6 mol SO3 hingga terdisosiasi 50% menurut persamaan reaksi :
2SO3(g) ↔ 2SO2(g) + O2(g)
Nilai tetapan kesetimbangan (Kc ) untuk reaksi tersebut adalah …
a. 0,010
b. 0,015
c. 0,020
d. 0,025
e. 0,030
Pembahasan :
Diketahui :
volume = 10 liter
Mol zat awal SO3 = 0,6 mol
α = 50 %
mol zat terurai = α x mol SO3 awal
= 50 % x 0,6
Jawaban : B
37. Dalam ruang tertutup yang volumenya 10 liter pada suhu dan tekanan tertentu 0,1 mol gas N2O4 terdisosiasi dengan derajat disosiasi (a) = 0,5 menurut persamaan reaksi :
N2O4 (g) ↔ 2NO2(g)
Nilai tetapan kesetimbangan (Kc) pada reaksi tersebut adalah…
a. 0,02
b. 0,05
c. 0,10
d. 0,20
e. 0,50
(Kimia SMA XI, Unggul Sudarmo, Erlangga, 2013, h. 173)
Jawaban : A
Pembahasan :
38. Diketahui reaksi kesetimbangan : FeO4(s) + CO (g)↔Fe (s) + CO2(s). Jika pada saat setimbangan terdapat 0,2 mol Fe3O4, 0,3 mol CO, 0,6 mol Fe dan 0,1 mol CO2 dan tekanan total sebesar 3 atm maka harga Kp adalah…
a. 0,23
b. 0,43
c. 63
d. 0,33
e. 0,53
Jawaban : D
Pembahasan :
39. Untuk kesetimbangan A + B ↔ C Apabila diketahui tekanan gas parsial PA = 0,1, PB = 02 dan Pc = 0,3 maka Kp adalah…
a. 12
b. 15
c. 16
d. 18
e. 20
Jawaban : B
Pembahasan :
40. Rumusan hukum kesetimbangan bagi reaksi kesetimbangan
tentukanlah menurut opsi dibawah ini yang benar adalah…
Jawaban : D
Pembahasan :
Nilai Kc untuk reaksi kesetimbangan heterogen.
Karena jika terdapat larutan dan fase padat yang menentukan Kc nya adalah larutan zat yang berwujud padat tidak mempunyai konsentrasi, dan pada reaksi yang melibatkan larutan dan fase padat, air yang hanya berfungsi sebagai pelarut dianggap tidak ikut beraksi, jika ikut bereaksi konsentrasinya dianggap tetap karena jumlahnya yang yang jauh lebih besar dibandingkan zat lainnya.
41 – 50 Contoh Soal Kesetimbangan Kimia dan Jawaban
41. Dalam ruang 1 liter, pada temperatur 27oC terdapat kesetimbangan
PCl5 (g)↔PCl3 (g) + Cl2 (g)
Jika pada keadaan tersebut harga Kc = 0,25 M dan R = 0,082 L atm K-1 mol -1 berapa harga Kp zat tersebut …
a. 7,15 atm
b. 6,5 atm
c. 6,20 atm
d. 6,13 atm
e. 7,0 atm
Jawaban : D
Pembahasan :
42. Reaksi homogen yang tidak pengaruhi oleh perubahan volume adalah…
a. 2NO2↔2NO + O2
b. 2NH3↔N2 + 3H2
c. PCl5 ↔ PCl3 + Cl2
d. 2HCl ↔ H2 + Cl2
e. B dan c benar
Pembahasan :
Bila volume diperbesar kesetimbangan akan bergeser menuju keruas dengan jumlah molekul atau partikel ( jumlah koefisien reaksi ) yang besar.
Jadi, pada reaksi 2HCl ↔ H2 + Cl2 jumlah koefisien pada ruas kiri dan kanan yaitu sama sehingga tidak dipengaruhi oleh volume.
Jawaban : D
43. Pada reaksi kesetimbangan :
CO + H2O ↔ CO2 + H2
Nilai K = 0,80. Untuk menghasilkan 4 mol H2 4 mol H2 per liter dari 6 mol H2O perliter, jumlah gas CO yang ditambahkan adalah..
a. 20 mol L‾¹
b. 16 mol L‾¹
c. 14 mol L‾¹
d. 12 mol L‾¹
e. 10 mol L‾¹
Pembahasan :
Jawaban : A
44. Pada suhu T°C dalam sebuah bejana V liter terdapat kesetimbangan 2X (g) ↔3Y (g). Harga Kp pada suhu tersebut adalah ½ . apabila harga Px = 4 atm, harga Py pada suhu tersebut … atm
a. 1,3
b. 2,0
c. 5,0
d. 8,0
e. 32,0
Jawaban : B
Pembahasan :
Kp = ½
Harga Px = 4 atm
Ditanya, Py ?
45. Tetapan kesetimbangan reaksi 2BaO2(s)↔2BaO (s) + O2(g) diberikan oleh …
Jawaban : E
Pembahasan :
Karena jika terdapat fase gas dan fase padat yang menentukan Kc adalah fase gas. Pada Kc solid dan liquid diabaikan karena tekanan dan konsentrasinya sangat kecil sehingga diabaikan. Dan juga solid dan liquid diabaikan karena pergerakan partikel solid dan liquid itu sangat lambat sehingga tidak mempengaruhi kesetimbangan.
Baca Juga : Soal Laju Reaksi
46. Pada Suhu T°C dalam sebuah bejana 5 liter terdapat kesetimbangan berikut :
2X(g) ↔ 3Y(g). Nilai Kp pada suhu tersebut adalah 1/2 . Bila nilai Px = 4 atm, maka nilai PY pada suhu tersebut adalah . . .
a. 3 atm
b. 0 atm
c. 6 atm
d. 0 atm
e. 0 atm
Pembahasan :
Jawaban : B
47. Pada keadaan kesetimbangan kimia, pernyataan berikut yang benar adalah . . . .
a. Mol pereaksi yang berubah sama dengan mol zat yang terbentuk
b. Konsentrasi zat – zat dalam campuran reaksi tidak berubah
c. Laju reaksi maju lebih cepat daripada laju reaksi balik
d. Mol zat pereaksi sama dengan mol zat hasil reaksi
e. Reaksi telah berganti
Jawaban : B
Pembahasan :
Pada suatu reaksi yang telah mencapai keadaan setimbang maka konsentrasi zat-zat dalam campuran reaksi tidak berubah.
48. Dalam bejana bervolume 2 L terdapat keetimbangan reaksi N2(g) + 3H2(g) ↔ 2NH3(g). pada keadaan setimbang terdapat 2 mol N2, 4 mol H2, dan 8 mol NH3. Harga tetapan kesetimbangan reaksi tersebut adalah ….
a. 0,5
b. 1,0
c. 1,5
d. 2,0
e. 2,5
Pembahasan :
Jawaban : D
49. Pada reaksi kesetimbangan CO(g) + H2O(g) ↔ H2(g) + CO2(g) tetapan kesetimbangannya = 1,00.
Banyaknya mol CO yang ditambahkan kedalam 3 mol H2O supaya terbentuk 2 mol H2 dan CO2 adalah . . . .
a. 3 mol
b. 4 mol
c. 4/3 mol
d. ¾ mol
e. 6 mol
Pembahasan :
Jawaban: C
50. Pada temperatur 200 K , harga Kc untuk suatu reaksi kesetimbangan gas 2PQ(g) ↔ P2(g) + Q2(g) adalah 473. Jika R= 0,082 atm mol-1 K-1 maka harga Kp untuk reaksi tersebut adalah . . . .
a. 0,01
b. 100
c. 236,5
d. 473
e. 946
(Sri rahayu Ningsih, 2001, Sains Kimia Kelas XI, Jakarta: Bumi Aksara. Hal. 144. No. 14)
Pembahasan
Diket :
2PQ(g) ↔ P2(g) + Q2(g)
Kc = 473
R = 0,082
T = 200 K
Dn = 0
dit : Kp
Maka :
Kp = Kc (RT)Dn
Kp = 473 (0,082 x 200 )0
Kp = 473 (16,4)0
Kp = 473 (1)
Kp = 473
Jawaban : D
51 – 60 Contoh Soal Kesetimbangan Kimia dan Jawaban
51. Pada temperatur tinggi, bila gas karbon monoksida bereaksi dengan gas hydrogen akan menghasilkan methanol seperti pada persamaan reaksi berikut ini.
CO(g) + 2H2(g) ↔ CH3OH(g)
Bila 0,4 mol CO dan 0,30 mol H2 Bereaksi dalam wadah 1 L dan mencapai kesetimbangan ternyata terbentuk 0,06 mol CH3OH. Nilai Kc untuk reaksi tersebut adalah . . . .
a. 0,50
b. 0,98
c. 1,70
d. 2,0
e. 5,4
(Haris Watoni, 2014, Kimia untuk SMA Kelas XI kelompok peminatan Matematika dan IPA, Bandung : Yrama Widya. Hal. 206. No.7.)
Pembahasan
Diket :
CO = 0,4 mol
H2 = 0,30 mol
CH3OH = 0,06 mol
Dit : Kc
Penyelesaian :
Kc = [CH3OH] / [H2]2 [CO]
Kc = 0,06 / [0,30]2 [0,40]
Kc = 0,06 / (0,09) (0,4)
Kc = 0,06/0,036
Kc = 1,6667 ~ 1,7
Jawaban : C
52. Pada suhu tertentu dalam ruang 10 L terdapat Kesetimbangan dari reaksi
2SO3(g) ↔ 2SO2(g) + O2(g)
Apabila 80 gr SO3 (S= 32, O = 16) dipanaskan hingga tercapai keadaan setimbang pada suhu tersebut, didapat perbandingan mol SO3 : O2 = 2: 1 Tetapan Kesetimbangan dari reaksi adalah . . . .
a. 25
b. 2,5
c. 0,4
d. 0,04
e. 0,025
Pembahasan :
Diket :
gr SO3 = 80 gr
SO3 : O2 = 2 : 1
V = 10 L
2SO3(g) ↔ 2SO2(g) + O2(g)
Dit : Kc
Penyelesaian :
Jawaban : E
53. Pada temperatur 900 K , reaksi :
2SO2(g) + O2(g) ↔ 2SO3(g) , mempunyai nilai Kp = 0,345. Dalam keadaan setimbang dari ketiga campuran gas tersebut, tekanan parsial SO2 dan O2 masing – masing adalah 0,215 atm dan 0,679 atm.
Nilai tekanan parsial gas SO3 dalam keadaan setimbang adalah . . . . atm.
a. 0,0504
b. 0,1040
c. 0,0108
d. 0,3020
e. 0,0910
(A. Haris Watoni, 2014, Kimia untuk SMA Kelas XI kelompok peminatan Matematika dan IPA, Bandung : Yrama Widya. Hal. 206. No.8.)
Pembahasan
Diket :
kp = 0,345
P SO2 = 0,215 atm
P O2 = 0,679 atm
Dit : SO3
Penyelesaian :
Jawaban : B
54. Nilai Kc dari reaksi sintesis ammonia berikut pada suhu 375 ° C adalah 1,2.
N2(g) + 3H2(g) ↔ 2NH3(g)
Berapa nilai Kp reaksi ini ?
a. 4,1 x 10-8
b. 1,3 x 10-3
c. 4,2 x 10-4
d. 3,4 x 103
e. 3,4 x 104
(A. Haris Watoni, 2014, Kimia untuk SMA Kelas XI kelompok peminatan Matematika dan IPA, Bandung : Yrama Widya. Hal. 206. No.12.)
Pembahasan
Diket : Kc = 1,2
T = 375°C (375 + 273 = 648 ° K)
N2(g) + 3H2(g) ↔ 2NH3(g)
Dit : Kp ?
Penyelesaian :
Dn = ruas kanan – ruas kiri
= 2 – 4 = -2
Kp = Kc (RT)Dn
Kp = 1,2 (0,082 x 648)–2
Kp = 1,2 / (2823,434496)
Kp = 0.0004250143
Kp = 4.2 x 10-4
Jawaban : C
55. Pada reaksi kesetimbangan 2HI(g) ↔ H2(g) + I2(g) , 0,1 mol HI dipanaskan sehingga terbentuk 0,02 mol I2. Derajat disosiasi HI adalah . . . .
a. 0,2
b. 0,3
c. 0,4
d. 0,5
e. 0,6
(Riandi Hidayat, 2014, Panduan Belajar kimia 2A,Jakarta: Yudistira. Hal. 131. No. 24)
Pembahasan
Diket :
2HI(g) ↔ H2(g) + I2(g)
I2 : 0,02 mol
HI = 0,1
a = 0,2
Jawaban : A
Baca Juga : Soal Lipid (Lemak)
56. Perhatikan reaksi kesetimbangan berikut .
Jika natrium hidrogen karbonat dipanaskan dalam ruang hampa pada suhu tertentu, tekanan dalam sistem kesetimbangan adalah P atm. Tetapan kesetimbangan Kp bagi reaksi ini adalah . . . .
a. Kp = P
b. Kp = 2P
c. Kp = ¼ P2
d. Kp = p2
e. Kp = ½ P2
(Riandi Hidayat, 2014, Panduan Belajar kimia 2A,Jakarta: Yudistira. Hal. 130. No.15.)
Pembahasan
Jawaban : D
57. Pada suhu 700 K terjadi reaksi kesetimbangan :
CO2(g) + H2(g) ↔ CO(g) + H2O(l) dengan nilai Kc = 0,11
Nilai Kp untuk reaksi tersebut adalah . . . .
a. 0,99
b. 9,99
c. 0,11
d. 11,0
e. 110
(A. Haris Watoni, 2014, Kimia untuk SMA Kelas XI kelompok peminatan Matematika dan IPA, Bandung : Yrama Widya. Hal. 207. No.15.)
Pembahasan
Jawaban: C
58. Dalam ruang 1 liter dimasukkan gas SO3 sebanyak 6 mol dan terurai menurut persamaan reaksi :
2SO3(g) ↔ 2 SO2(g) + O2(g)
Setelah reaksi berada dalam keadaan setimbang didapatkan gas oksigen sebanyak 2 mol. Nilai Kc reaksi tersebut adalah . . . .
a. 4
b. 6
c. 8
d. 10
e. 12
(Mustafal Bakri, 2012, Seri Pendalaman Materi Kimia untuk SMA / MA, Jakarta : esis. Hal. 96. No 10)
Pembahasan :
Jawaban : C
59. Dalam suatu ruangan 2 liter direaksikan 4 mol gas A dan 6 mol gas B dengan reaksi sebagai berikut :
2A(g) + 3B(g) ↔ 2C(g) + 2D(g)
Setelah tercapai kesetimbangan didapatkan gas A tersisa sebanyak 2 mol. nilai tetapan kesetimbangan (Kc) reaksi tersebut adalah . . . .
a. 1/3
b. 2/3
c.1/27
d. 8/27
e. 3/32
(Mustafal Bakri, 2012, Seri Pendalaman Materi Kimia untuk SMA / MA, Jakarta : esis. Hal. 96. No 11)
Pembahasan :
Jawaban : D
60. 0,08 mol SO3 terurai dan terbentuk 0,1 mol SO2, maka derajat disosiasi SO3 sebesar . . . .
a. 1,25
b. 3,00
c. 4,25
d. 5,25
e. 6,15
Pembahasan
2SO3 ↔ 2SO2 + O2
Mol terurai = 0.1 mol
Mol mula – mula = 0,08
a = Jumlah zat terurai / jumlah zat mula-mula
a = 0.1 / 0.08
a = 1,25
Jawaban : A
Download Soal Kesetimbangan Kimia
Sudah selesai membaca dan berlatih soal Kesetimbangan Kimia ini ? Ayo lihat dulu Daftar Soal Kimia lainnya


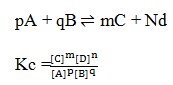
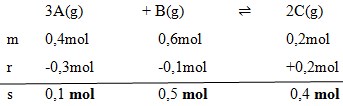


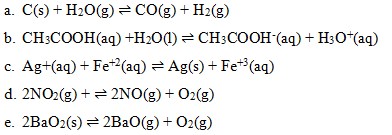
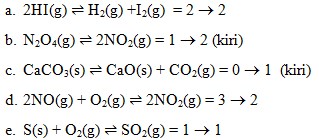

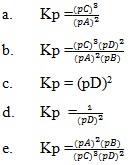

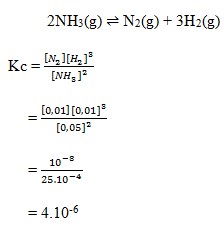

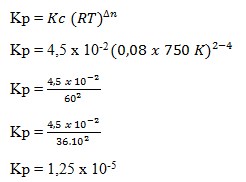


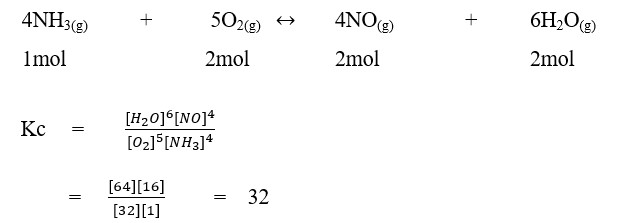

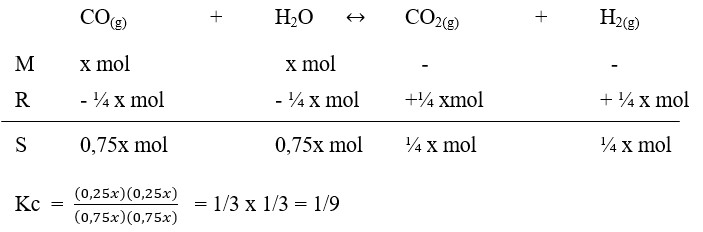

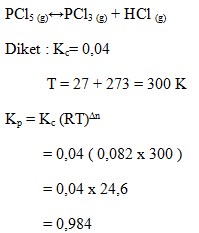
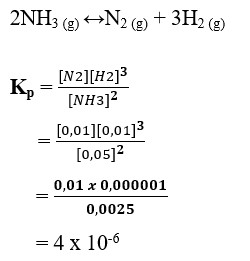
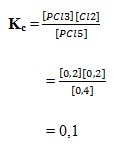




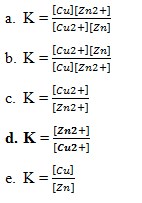


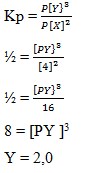
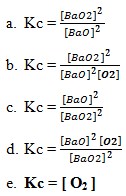
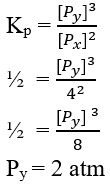
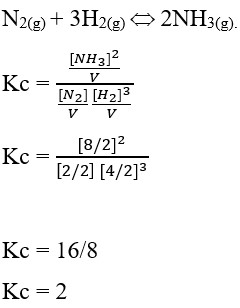
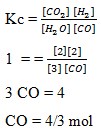



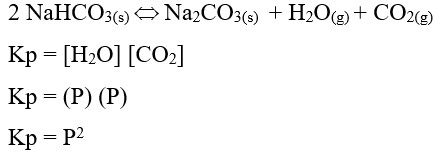

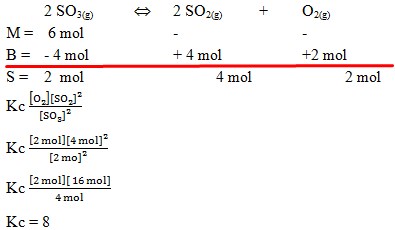
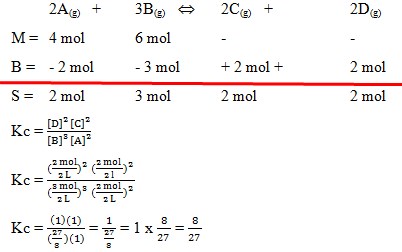



bagus sekali, dan terima kasih ijin download, muga bermanfaat bagi kami, semoga barokah bagi Mas Anas Ilham dan keluarga, . Semoga Sukses dan tetap semangat dan sehat , aamiin .
MasyaAllah bermanfaat sekali. Izin download mas untuk dibagikan ke murid-murid. Jazakallahu khairan. Barakallahu fiik
Boleh tanya tidak? Untuk soal 57. Cara cari RT nya bagaimana si?
R = ketetapan gas universal yaitu 0.0820574587 L·atm·K−1·mol−1
T = suhu dalam kelvin
Alhamdulillah……ijin download Mas Anas sekaligus saya gunakan untuk tambahan materi untuk pemahaman siswa saya, semoga menjadi amal hasanah panjenengan dan bermanfaat untuk semua, aamiiin.