Elektrokimia – Pengertian, Penggolongan dan Penerapan dalam Kehidupan – Elektrokimia adalah ilmu yang mempelajari aspek elektronik dan reaksi kimia. Elemen yang digunakan dalam reaksi elektrokimia di karakterisasikan dengan banyaknya elektron yang dimiliki. Dengan kata lain adalah cabang ilmu kimia yang berhubungan dengan arus listrik dan potensi. Elektrokimia dapat diaplikasikan dalam berbagai keperluan manusia, seperti keperluan sehari-hari dalam skala rumah tangga dan industri-industri besar seperti industri yang memproduksi bahan-bahan kimia baik organic maupun anorganik, farmasi, polimer, otomotif, perhiasan, pertambangan, pengolahan limbah dan bidang analisis.

Metode elektrokimia adalah metode yang didasarkan pada reaksi redoks, yakni gabungan dari reaksi reduksi dan oksidasi, yang berlangsung pada elektroda yang sama/ berbeda dalam suatu sistem elektrokimia. Sistem elektrokimia meliputi sel elektrokimia dan reaksi elektrokimia.
Sel elektrolisis merupakan pemanfaatan arus listrik untuk menghasilkan reaksi redoks. Oleh karena itu, elektrolisis adalah proses penguraian suatu senyawa dengan pengaliran arus listrik yang melaluinya. Dalam elektrolisis terjadi perubahan energi listrik menjadi energi kimia. Sel elektrolisis merupakan kebalikan dari sel volta karena listrik digunakan untuk melangsungkan reaksi redoks tak spontan. Proses elektrolisis dimulai dengan masuknya elektron dari arus listrik searah kedalam larutan melalui kutub negatif. Sehingga, diharapkan makalah ini dapat membahas secara lebih detail tentang sel elektrokimia.
Secara garis besar, sel elektrokimia dapat digolongkan menjadi dua yaitu Sel Galvani, Sel Elektrolisis.
Simak Juga : Soal Elektrokimia dan Sel Elektrolisis Pilihan Ganda
A. Pengertian Elektrokimia
Elektrokimia merupakan reaksi yang mengubah reaksi kimia dan menghasilkan energy listrik atau sebaliknya. Pengubahan energi kimia menjadi energi listrik dapat berlangsung dalam sebuah sel volta berlangsung secara proses spontan, sebaliknya dalam sel elektrolisis merupakan proses tak spontan. Berdasarkan sifat listriknya, zat-zat dapat dibedakan menjadi dua kelompok, yaitu konduktor dan isolator. Konduktor dapat menghantarkan listrik sedangkan isolator tidak dapat. Terjadinya aliran listrik dapat disebabkan oleh gerakan elektron, bila gerakan elektron itu terjadi didalam logam disebut penghantaran metalik dalam hal ini tidak mengakibatkan terjadinya reaksi kimia. Larutan elektrolit dapat pula menghantarkan listrik, hal ini terjadi karena tersalurnya arus listrik bukan disebabkan oleh gerakan elektron didalam larutan, dalam hal ini disertai dengan terjadinya reaksi kimia.
B. Penggolongan Elektrokimia
Sel Volta (Sel Galvani)
Sel volta (sel galvani) adalah sel elektrokimia di mana energi kimia dari reaksi redoks spontan diubah menjadi energi listrik. Prinsip kerja sel volta dalam menghasilkan arus listrik adalah aliran transfer elektron dari reaksi oksidasi di anode ke reaksi reduksi di katode melalui rangkaian luar.
Prinsip-prinsip Sel Volta atau Sel Galvani :
- Gerakan electron dalam sirkuit eksternal akibat adanya reaksi redoks.
- Terjadi perubahan energi kimia → energi listrik
- Pada anoda, electron adalah produk dari reaksi oksidasi (anoda kutub negative)
- Pada katoda, electron adalah reaktan dari reaksi reduksi (katoda kutub positif)
- Arus electron mengalir dari anoda ke katoda, arus listrik mengalir dari katoda → anoda.
- Jembatan garam menyetimbangkan ion-ion dalam larutan.
Konsep-konsep sel Volta
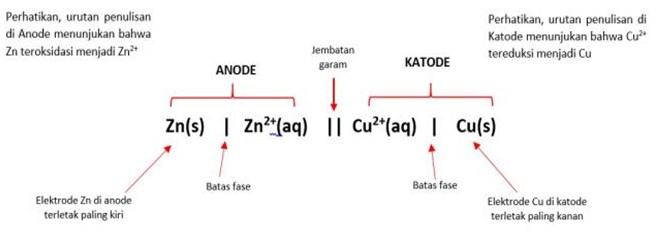
Notasi sel
Contoh :
Zn | Zn+2 || Cu+2 | Cu
Dimana :
- Notasi sel terdiri dari anode dan katode
- Tanda || adalah jembatan garam untuk memisahkan fase berbeda.
- Tanda | adalah batas fase untuk memisahkan fase berbeda.
- Elektrode anode terletak paling kiri dan elektrode katode paling kanan.
Untuk lebih jelasnya, simak penulisan notasi sel volta berikut.
Suatu sel volta terdiri dari anode Zn dan katode Cu. Di anode, Zn teroksidasi menjadi Zn2+ dan dikatode, Cu2+ tereduksi menjadi Cu.
Reaksi sel; Zn(s) + Cu2+(aq) → Cu(s) + Zn2+(aq)
Notasi sel volta:
Deret Volta
Deret volta yang umum dipakai sebagai berikut :
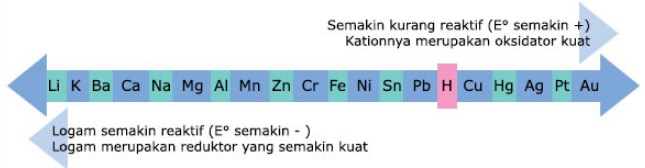
Dari deret di atas, makin ke kiri kedudukan suatu logam, maka :
- Logam tersebut makin reaktif (makin mudah melepas elektron)
- Logam sebelah kiri merupakan reduktor yang makin kuat. Konsekwensi dari hal ini, maka logam yang makin ke kiri memiliki sifat yang makin mudah teroksidasi.
- Logam sebelah kiri akan mereduksi ion logam sebelah kanannya, sebaliknya ion logam sebelah kanan akan mengoksidasi logam sebelah kirinya.
Hal sebaliknya terjadi jika ditinjau kedudukan logam yang makin ke kanan :
- Logam sebelah kanan semakin kurang reaktif (makin sulit melepas elektron)
- Logam sebelah kanan merupakan oksidator yang makin kuat (makin mudah tereduksi)
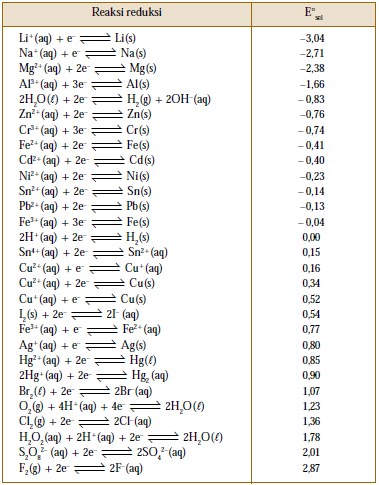
Potensial Reduksi Standar
Harga potensial reduksi standar dengan aktivitas satu pada suhu 25 °C di antaranya seperti pada tabel berikut :
Sel Elektrolisis
Berlawanan dengan pembahasan sebelumnya elektrokimia/ sel volta, yang memanfaatkan reaksi redoks spontan untuk menghasilkan energi listrik.
Sel Elektrolisis adalah sel yang menggunakan energi listrik untuk menghasilkan reaksi kimia yang tidak spontan.
Prinsip dasar elektrolisis adalah :
- Memanfaatkan reaksi oksidasi dan reduksi (redoks)
- Tidak memerlukan jembatan garam seperti sel volta. (sel elektrokimia)
Elektrode pada sel elektrolis terdiri atas katode yang bermuatan negatif dan anode yang bermuatan positif. Hal inilah yang membedakan antara sel elektrolis dengan sel elektrokimia. Berikut prinsip dasar elektrolis berlawanan dengan elektrokimia, yaitu :
- Reaksi elektrolis, mengubah energi listrik menjadi energi kimia
- Reaksi elektrolis, merupakan reaksi tidak spontan, karena melibatkan energi listrik dan luar.
- Reaksi elektrolis berlangsung di dalam sel selektrolis, yaitu terdiri dari satu jenis larutan atau leburan elektrolit dan memiliki dua macam elektrode, yaitu :
– Elektrode (-) : Elektrode yang dihubungkan dengan kutub (-) sumber arus listrik
– Elektrode (+) : Elektrode yang dihubungkan dengan kutub (+) sumber arus listrik
Bila suatu cairan atau larutan elektrolit dialiri arus listrik arus searah melalui batang elektrode, maka ion-ion yang ada di dalam cairan atau larutan tersebut akan bergerak menuju ke elektrode yang berlawananan muatannya. Pada sel elektrolis kutub positif merupakan terjadinya ionisasi (oksidasi) sehingga disebut anode & kutub negatif merupakan tempat terjadinya reduksi sehingga disebut katode.
Kelompok sel elektrolisis, yaitu :
1. Sel elektrolisis bentuk lelehan/leburan
Sel bentuk ini hanya berlaku untuk senyawa inonik dengan tidak ada zat pelarut (tidak ada H2O), hanya ada kation dan anion.
2. Sel elektrolisis bentuk larutan dengan elektrode tidak bereaksi (inert/tidak aktif)
Sel bentuk ini tidak ada pengaruh elektrode, hanya saya selain kation dan anion juga diperhitungkan adanya zat larut (adanya air)
3. Sel elektrolis bentuk larutan dengan elektrode aktif
Elektrode yang bereaksi adalah tembaga (Cu), perak (Ag), Nikel (Ni), besi (Fe), dll. Elektrode ini hanya bereaksi di anode, sedangkan dikatodenya tidak.
Contoh elektrolisis:
Elektrolisis larutan HCl dengan elektroda Pt, reaksinya:
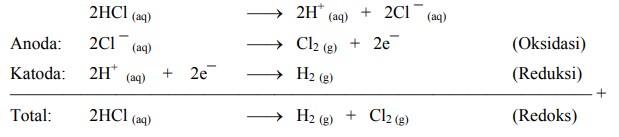
Elektrolisis larutan NaOH dengan elektroda Pt, reaksinya:
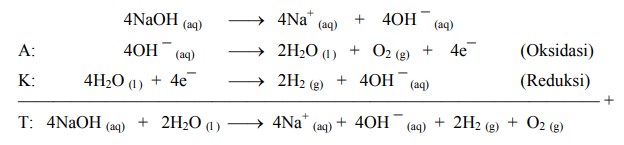
Proses elektrolisis dalam industri misalnya:
- Penyepuhan (melapisi logam dengan logam lebih mulia misal Ni, Cr, atau Au).
- Pemurnian logam (misal Ag, Cu, Au).
- Pembuatan senyawa (misal NaOH) atau gas (misal O, H2, Cl2).
C. Hukum Faraday
Akibat aliran arus listrik searah ke dalam larutan elektrolit akan terjadi perubahan kimia dalam larutan tersebut. Menurut Michael Faraday (1834) lewatnya arus 1 F mengakibatkan oksidasi 1 massa ekivalen suatu zat pada suatu elektroda (anoda) dan reduksi 1 massa ekivalen suatu zat pada elektroda yang lain (katoda).
Hukum Faraday I:
Massa zat yang timbul pada elektroda karena elektrolisis berbanding lurus dengan jumlah listrik yang mengalir melalui larutan.
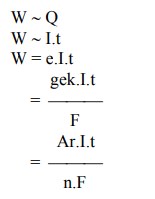
Keterangan :
w = berat zat yang diendapkan (g).
Q = jumlah arus listrik = muatan listrik (C)
e = tetapan = (gek : F)
I = kuat arus listrik (A)
t = waktu (dt).
gek = massa ekivalen zat (gek).
Ar = massa atom relatif.
n = valensi ion.
F = bilangan faraday = 96500 C.
Massa ekivalen = massa zat yang sebanding dengan 1 mol elektron = 6,02 x 1023 e¯ 1 gek ∼ 1 mol e¯
Jika arus listrik 1 F dialirkan ke dalam larutan AgNO3 maka akan diendapkan 1 gram ekivalen Ag.

Jika listrik 1 F dialirkan ke dalam larutan CuSO4 maka akan diendapkan 1 gek Cu.
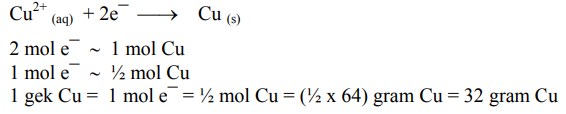
Q = banyaknya arus listrik yang dialirkan (Coulomb) = I . t (Ampere.detik)
Muatan 1 e¯ = 1,6 x 10¯19 C
Muatan 1 mol e¯ = (6,02 x 1023) x (1,6 x 10¯19) C
≈ 96 500 C
= 1 F
Contoh soal :
1. Berapa gram Ni yang diendapkan pada elektrolisis larutan NiSO4 dengan arus listrik 24 125 C ?
Jawaban :
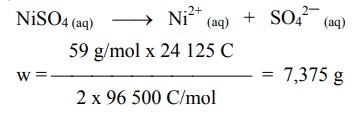
2. Bila arus 20 A dialirkan melalui leburan kriolit yang mengandung Al2O3 selama 50 menit, berapa gram Al yang terbentuk dan berapa liter gas O2 yang timbul jika diukur pada keadaan standar (STP) ?
Jawaban :

Hukum Faraday II:
Massa dari bermacam-macam zat yang timbul pada elektrolisis dengan jumlah listrik sama, berbanding lurus dengan massa ekivalennya.
Contoh:
Jika arus 1 F dialirkan ke dalam tiga larutan, yaitu CuSO4, AuCl3 dan AgNO3, maka perbandingan massa Cu : Au : Ag sesuai dengan perbandingan massa ekivalennya, yaitu:

D. Penerapan Sel Volta dalam Pembuatan Aki
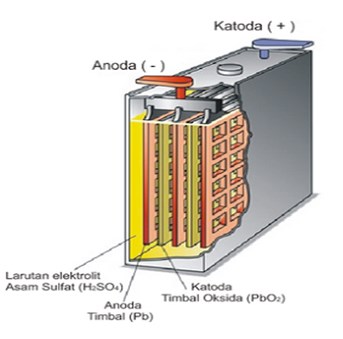
Aki / Baterai Timbal (Accu)
Nilai sel terletak pada kegunaannya. Diantara berbagai sel, sel timbal (aki) telah digunakan sejak 1915. Berkat sel ini, mobil/sepeda motor dapat mencapai mobilitasnya, dan akibatnya menjadi alat transportasi terpenting saat ini. Baterai timbal dapat bertahan kondisi yang ekstrim (temperatur yang bervariasi, shock mekanik akibat jalan yang rusak, dll) dan dapat digunakan secara kontinyu beberapa tahun.
Dalam baterai timbal, elektroda negatif adalah logam timbal (Pb) dan elektroda positifnya adala timbal yang dilapisi timbal oksida (PbO2), dan kedua elektroda dicelupkan dalam larutan elektrolit asam sulfat (H2SO4). Reaksi elektrodanya adalah sebagai berikut :
Anoda Pb (-) : Pb + SO42- → PbSO4 + 2e–
Katoda PbO2 (+) : PbO2 + SO42- + 4H+ + 2e– → PbSO4 + 2H2O
Reaksi total : Pb + PbO2 + 4H+ + 2SO42- → 2PbSO4 + 2H2O
Kondisi Saat aki digunakan :
Saat aki menghasilkan listrik, Anoda Pb dan katoda PbO2 bereaksi dengan SO42- menghasilkan PbSO4. PbSO4 yang dihasilkan dapat menutupi permukaan lempeng anoda dan katoda. Jika telah terlapisi seluruhnya maka lempeng anoda dan katoda tidak berfungsi. Akibatnya aki berhenti menghasilkan listrik.
Saat aki menghasilkan listrik dibutuhkan ion H+ dan ion SO42- yang aktif bereaksi. akibatnya jumlah ion H+ dan ion SO42- pada larutan semakin berkurang dan larutan elektrolit menjadi encer maka arus listrik yang dihasilkan dan potensial aki semakin melemah.
Oleh karena reaksi elektrokimia pada aki merupakan reaksi kesetimbangan (reversibel) maka dengan memberikan arus listrik dari luar ( mencas ) keadaan 2 elektroda (anoda dan katoda) yang terlapisi dapat kembali seperti semula. demikian pula ion akan terbentuk lagi sehingga konsentrasi larutan elektrolit naik kembali seperti semula.
Anoda PbO2 ( – ) : PbSO4 + 2H2O → PbO2 + 4H+ + SO42- + 2e–
Katoda Pb ( + ) : PbSO4 + 2e– → Pb + SO42-
Reaksi total : 2PbSO4 + 2H2O → Pb + PbO2 + 4H+ + 2SO42-
Selama proses penggunaan maupun pengecasan aki terjadi reaksi sampingan yaitu elektrolisis air dan tentu saja ada air yang menguap dengan demikian penting untuk menambahkan air terdistilasi ke dalam baterai timbal. Baru-baru ini jenis baru elektroda yang terbuat dari paduan timbal dan kalsium, yang dapat mencegah elektrolisis air telah dikembangkan. Baterai modern dengan jenis elektroda ini adalah sistem tertutup dan disebut dengan baterai penyimpan tertutup yang tidak memerlukan penambahan air.
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia



