Gas Ideal dan Teori Kinetik Gas – Pengertian, Rumus, dan Contohnya – Teori kinetik merupakan teori yang menjelaskan perilaku sistem – sistem fisis dengan menganggap bahwa sistem-sistem fisis tersebut terdiri atas sejumlah besar molekul yang bergerak sangat cepat.

Teori kinetik gas adalah teori yang digunakan untuk menjelaskan sifat-sifat atau kelakuan suatu gas. Teori kinetik gas tidak mengutamakan kelakuan sebuah partikel, tetapi meninjau sifat zat secara keseluruhan sebagai hasil rata-rata kelakuan partikel tersebut .
Simak Juga : Contoh Soal Teori Kinetik Gas dan Jawaban [+Pembahasan]
A. Sejarah Teori Kinetik Gas
Pengamatan dari kelakuan gas pada berbagai kondisi yang dilakukan oleh Boyle, Charles, Avogadro dan lain-lain menghasilkan data yang dapat disimpulkan menjadi perumusan-perumusan umum atau hukum. Hukum-hukum ini tidak bergantung pada setiap teori tentang hakekat gas.
Untuk dapat menerangkan kelakuan gas itu telah disusun suatu teori yang dikenal sebagai Teori Kinetik Gas. Teori ini, yang untuk pertama kalinya dikemukakan oleh Bernoulli pada tahun 1738, mempostulatkan suatu model dimana diandaikan bahwa molekul-molekul gas berada dalam gerakan cepat ke segala arah dan bahwa tabrakannya dengan dinding menimbulkan tekanan gas.
Walaupun Bernoulli berhasil menurunkan hukum Boyle, namun teorinya baru mendapat perhatian kurang lebih satu abad kemudian, antara lain dari Joule (1848), Krönig (1856) dan Clausius (1837) yang mengembangkan teori tersebut lebih lanjut.
Teori ini didasarkan atas beberapa postulat sebagai berikut:
- Gas terdiri atas sejumlah besar partikel-partikel kecil (molekul) yang bergerak dengan cepat dalam garis lurus, yang saling bertabrakan dan yang bertabrakan dengan dinding. Tekanan gas adalah akibat dari pada tabrakan antara molekul dengan dinding.
- Tabrakan antar molekul bersifat kenyal (elastis) artinya walaupun pada tabrakan itu dapat terjadi pemindahan energi, akan tetapi energi kinetik total tidak berubah.
- Antara molekul-molekul dan antara molekul dengan dinding tidak ada gaya tarik menarik (interaction).
- Volum dari molekul–molekul cukup kecil dibandingkan terhadap volum total dari gas sehingga volume molekul dapat diabaikan.
- Energi kinetik rata-rata dari molekul-molekul berbanding lurus dengan temperatur molekul.
B. Pengertian Teori Kinetik Gas
Teori Kinetik Gas merupakan cabang ilmu fisika yang menjelaskan tentang sifat-sifat gas dengan menggunakan hukum-hukum Newton tentang gerak berdasarkan gerak acak partikel/molekul penyusun gas yang berlangsung terus menerus
Setiap benda, baik cairan, padatan, maupun gas tersusun atas atomatom, molekul-molekul, atau partikel-partikel. Oksigen, nitrogen, hidrogen, uap air, bahkan udara di sekitar kita merupakan contoh gas. Sifat-sifat gas dapat dibedakan menjadi sifat makroskopis dan sifat mikroskopis.
- Sifat makroskopis seperti temperatur, tekanan, dan volume.
- Sifat mikroskopis seperti kelajuan, massa tiap-tiap partikel penyusun inti, momentum, serta energi yang dikaitkan dengan tingkah laku partikel gas.
Teori Kinetik (atau teori kinetik pada gas) berupaya menjelaskan sifat-sifat makroskopis gas, seperti tekanan, suhu, atau volume, dengan memperhatikan komposisi molekular mereka dan gerakannya. Intinya, teori ini menyatakan bahwa tekanan tidaklah disebabkan oleh gerakan vibrasi (getaran) di antara molekul-molekul, seperti yang diduga Isaac Newton, melainkan disebabkan oleh tumbukan antarmolekul yang bergerak pada kecepatan yang berbeda-beda.
Teori Kinetik dikenal pula sebagai Teori Kinetik-Molekular atau Teori Tumbukan. Dengan demikian, teroi kinetika gas membahas sifat-sifat gas berdasarkan gerak acak partikelnya yang berlangsung terus menerus. Adapun gas yang akan dibahas adalah gas ideal, yaitu gas yang secara tepat memenuhi hukum-hukum gas.
C. Pengertian Gas Ideal
Gas yang akan kita bahas di sini adalah gas ideal. Gas ideal sebenarnya tidak ada di alam. Gas ideal merupakan penyederhanaan atau idealisasi dari gas yang sebenarnya (gas nyata) dengan membuang sifat-sifat yang tidak terlalu signifikan sehingga memudahkan analisis. Namun orang dapat menciptakan kondisi sehingga gas nyata memiliki sifat-sifat yang mendekati sifat-sifat gas ideal. Sifat-sifat gas pada tekanan rendah dan suhu kamar mendekati sifat-sifat gas ideal, sehingga gas tersebut dapat dianggap sebagai gas ideal.
Sifat-sifat gas ideal adalah sebagai berikut.
- Terdiri atas partikel (atom atau molekul) yang jumlahnya besar
- Partikel-partikel tersebut tersebar merata dalam seluruh ruang
- Partikel-partikel tersebut bergerak acak ke segala arah
- Jarak antar partikel jauh lebih besar dari ukuran partikelnya
- Tidak ada gaya interaksi antar partikel kecuali bila bertumbukan
- Semua tumbukan (antar partikel atau dengan dinding) bersifat lenting sempurna dan terjadi dalam waktu yang sangat singkat
- Hukum Newton tentang gerak berlaku
D. Persamaan Umum Gas Ideal
Dalam pembahasan keadaan gas, ada tiga besaran yang saling berhubungan. Besaran-besaran tersebut adalah tekanan (P), volume (V), dan temperatur mutlak (T). Hubungan ketiga besaran ini telah dipelajari dan diteliti oleh para ilmuwan. Untuk mengetahui bagaimana hubungan ketiga variabel tersebut, mari kita pelajari beberapa hukum mengenai gas ideal.
Hukum Boyle
Seorang ilmuwan yang menyelidiki hubungan volume dengan tekanan gas adalah Robert Boyle. Boyle telah menyelidiki hubungan tekanan dan volume gas dalam ruang tertutup pada temperatur tetap. Boyle menemukan bahwa :
“Jika suhu yang berada dalam ruang tertutup dijaga tetap, maka tekanan gas berbanding terbalik dengan volume gas”.
Hukum ini kemudian dikenal sebagai Hukum Boyle. Secara matematis, Hukum Boyle dituliskan dalam bentuk :
P V = konstan atau P1 V1 = P2 V2
Keterangan:
- P1 = Tekanan awal (N/m²)
- P2 = Tekanan akhir (N/m²)
- V1 = Volume awal (m3)
- V2 = Volume akhir (m3)
Dari persamaan Hukum Boyle tersebut, hubungan tekanan dan volume pada temperatur tetap dapat digambarkan dalam bentuk grafik seperti Gambar dibawah.
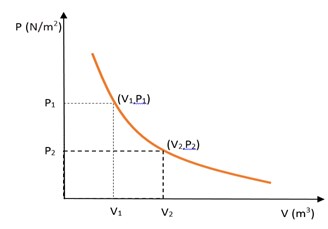
Proses isotermal (Suhu tetap)
Jika tekanan diturunkan, volume gas akan naik. Sebaliknya, jika tekanan dinaikkan, volume gas akan mengecil.
Contoh Penerapan Hukum Boyle
Salah satu penerapan prinsip hukum Boyle dapat dilihat pada semprotan obat nyamuk. Pompa berfungsi untuk mengubah volume gas dalam tabung semprotan. Saat pompa digerakkan ke kanan maka volume gas akan mengecil dan tekanan gas meningkat.
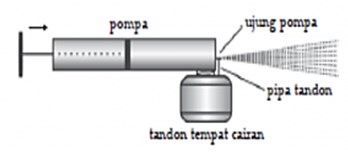
Tekanan gas yang besar keluar melalui ujung tabung dan membuat cairan pada pipa tandon tersemprot keluar. Sedangkan ketika pompa ditarik kearah kiri maka volume gas semakin besar dan tekanan gas dalam tabung menjadi menurun.
Contoh Soal
Suatu gas dengan volume 2 m³ berada dalam bejana tertutup (tidak bocor) yang suhunya dijaga tetap, tekanan mula-mula gas tersebut adalah 2 Pa. Jika tekanannya dinaikkan menjadi 4 Pa, tentukan besar volumenya ?
Penyelesaian :
Diketahui :
V1 = 2 m³
P1 = 2 Pa
P2 = 4 Pa
Ditanya : V2 = … ?
Jawaban :
P1 V1 = P2 V2
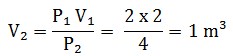
Jadi besar volumenya menjadi 1 m³
Hukum Charles
Berdasarkan penyelidikannya, Jacques Charles menemukan bahwa:
“Jika gas dalam ruang tertutup tekanannya dijaga konstan maka volume gas berbanding lurus dengan temperatur mutlaknya”
Pernyataan Charles ini dikenal sebagai Hukum Charles dan dituliskan dalam bentuk persamaan :

Grafik hubungan volume dan temperatur pada tekanan tetap :
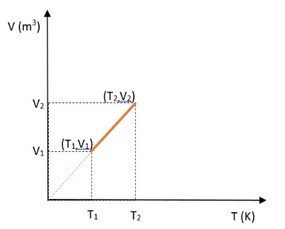
Keterangan:
V1 = Volume awal (m3)
V2 = Volume akhir (m3)
T1 = Suhu awal (K)
T2 = Suhu akhir (K)
Jika suhu gas biasanya dinyatakan dalam t℃, suhu mutlak T menggunakan satuan Kelvin (K) dinyatakan dengan persamaan : T = t + 273
Contoh peristiwa
Contoh peristiwa dapat dilihat secara langsung melalui balon yang ditempatkan pada mulut botol yang direndam air panas.
Gambar tersebut menunjukkan semakin tinggi suhu gas dalam botol maka volume gas juga membesar. Sebaliknya, semakin rendah suhu gas dalam botol maka semakin kecil volume gasnya.
Contoh Soal
Tekanan suatu gas dengan volume 3 m³ yang berada dalam bejana tertutup (tidak bocor) dijaga tetap. Suhu mutlaknya mula-mula 100 K. Jika volumenya diubah menjadi 6 m³, hitunglah besar suhu mutlaknya ?
Penyelesaian:
Diketahui :
V1 = 3 m³
T1 = 100 K
V2 = 6 m³
Ditanya : T2 = … ?
Jawaban :
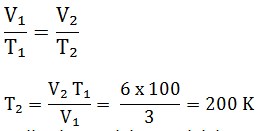
Jadi suhu mutlaknya adalah 200 K
Hukum Gay Lussac
Seorang ilmuwan bernama Joseph Gay Lussac, telah menyelidiki hubungan tekanan dan temperatur gas pada volume tetap. Gay Lussac menyatakan:
“Jika gas dalam ruang tertutup volumenya dijaga konstan maka tekanan gas berbanding lurus dengan temperatur mutlaknya”.
Pernyataan ini disebut Hukum Gay Lussac yang dituliskan dalam bentuk persamaan berikut:

(Grafik hubungan tekanan dan temperatur pada volume tetap) :
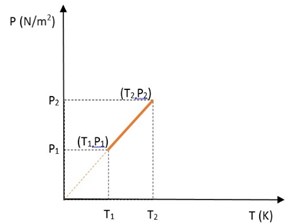
Keterangan:
P1 = Tekanan awal (N/m²)
P2 = Tekanan akhir (N/m²)
T1 = Suhu awal (K)
T2 = Suhu akhir (K)
Contoh Penerapan
Peristiwa yang berkaitan dengan pernyataan tersebut adalah botol pengharum ruangan yang dipanaskan. Semakin tinggi suhu botol saat dipanaskan maka semakin besar pula tekanan gas dalam botol sehingga menyebabkan botol akhirnya meledak.
Hukum Boyle – Gay Lussac
Ketiga hukum keadaan gas yang telah kita pelajari, yaitu hukum Boyle, hukum Charles, dan hukum Gay Lussac dapat digabungkan menjadi satu persamaan. Hasil gabungan ketiga hukum tersebut dikenal sebagai hukum Boyle – Gay Lussac. Hukum Boyle-Gay Lussac menyatakan hubungan antara suhu, tekanan dan volume gas. Hukum ini dinyatakan dalam bentuk persamaan :

Keterangan:
P1 = Tekanan awal (N/m²)
P2 = Tekanan akhir (N/m²)
V1 = Volume awal (m³)
V2 = Volume akhir (m³)
T1 = Suhu awal (K) T2 = Suhu akhir (K)
Contoh Soal
Suatu gas ideal sebanyak 4 liter memiliki tekanan 1,5 atmosfer dan suhu 27oC. Tentukan tekanan gas tersebut jika suhunya 47 oC dan volumenya 3,2 liter !
Penyelesaian:
Diketahui :
V1 = 4 liter
V2 = 3,2 liter
P1 = 1,5 atm
T1 = 27 oC = 27 + 273 = 300 K
T1 = 47 oC = 47 + 273 = 320 K
Ditanya : P2 = … ?
Jawaban :
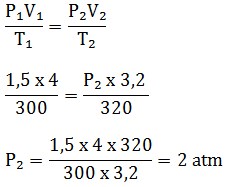
Persamaan Gas Ideal
PV = nRT
Keterangan :
P = tekanan gas (N/m2 = Pa)
V = volume gas (m3)
n = jumlah mol gas (mol)
T = suhu gas (K)
R = konstanta umum gas
Contoh Soal
Gas dalam ruang tertutup yang bervolume 20.000 liter dan suhu 27℃ memilki tekanan 10 atm. Tentukan jumlah mol gas yang berada dalam ruang tersebut ?
Penyelesaian:
Diketahui:
V = 20.000 liter
T = 27 ℃ = 27 + 273 = 300 K
P = 10 atm
Ditanya : n = … ?
Jawaban :
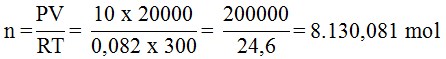
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Fisika



