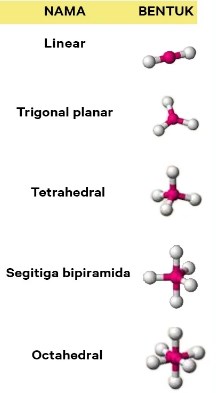
Contoh Soal Menentukan Bentuk Molekul (PEB dan PEI) dan Jawaban – Walaupun jumlah materi di alam sangat banyak dan beragam, tetapi pada dasarnya materi tersebut dibangun oleh beberapa jenis atom dengan struktur yang terbatas. Jumlah cara penyusunan atom dalam molekul tidak banyak sebab dibatasi oleh sudut antarikatan dan sifat partikel penyusunnya. Teori yang mengkaji aspek struktur molekul adalah teori ikatan valensi (berdasarkan mekanika kuantum), teori domain elektron (berdasarkan teori Lewis), dan teori hibridisasi. Terdapat sekitar tujuh bentuk molekul yang sederhana, yaitu bentuk linear, trigonal planar, trigonal piramidal, segiempat datar, tetrahedral, tirogonal bipiramidal, dan oktahedral.
Soalkimia.com Kali ini akan menyediakan contoh soal Cara Menentukan Bentuk Molekul (PEB dan PEI) sebanyak 11 butir yang kami rangkum dari berbagai penerbit buku untuk siswa pelajari dalam persiapan ulangan harian maupun Ujian Nasional. Karena soal ini sering muncul pada berbagai tes.

Diharapkan dengan mempelajari contoh soal Menentukan Bentuk Molekul pilihan ganda untuk kelas 10 ini siswa dapat mengerti dan paham konsep dasarnya.
1 – 10 Soal Menentukan Bentuk Molekul dan Jawaban
1. Tentukan bentuk molekul dari :
a. BeCl2 (4Be, 17Cl)
b. CO2 (4C, 8O)
Pembahasan :
2. Jika nomor atom A=5 dan B=17,orbital hibrida yang terjadi pada molekul AB adalah….
A. sp
B. sp²
C. sp³
D. sp³d
E. sp³d²
Jawaban : A
Pembahasan :
3. Molekul dengan orbital hibrida sp² memiliki bentuk orbital …
A. Linear
B. Segitiga datar
C. Segitiga piramida
D. Tetrahedral
E. Oktahedral
Jawaban : B
Pembahasan :
Segitiga datar atau trigonal planar merupakan bentuk molekul sp²
4. Bentuk molekul bipiramida trigonal memiliki orbital hibrida
A. sp
B. sp²
C. sp³
D. sp³d
E. sp³d²
Jawaban : D
Pembahasan :
Yang benar adalah : sp³d
Mengapa demikian?
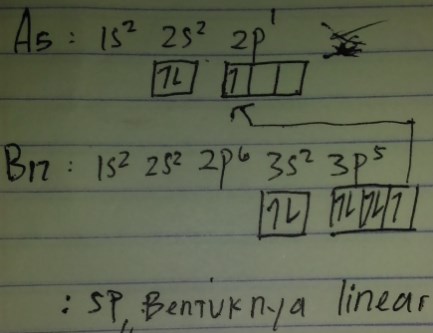
Contoh : bipiramida trigonal adalah PCl5
Membuktikannya, pertama konfigurasikan dengan asas aufbau unsur pusat yaitu P yg hanya terdiri 1 saja. P nomor atomnya 15
P : 1s², 2s², 2p6, 3s², 3p³
Ambil bagian terakhir mulai dari s
Berarti -> 3s² dan 3p³
5. Bentuk molekul NH3 (7N dan 1H) adalah …
A. Segitiga datar
B. Bentuk V
C. Tetrahedral
D. Segitiga piramida
E. Segitiga bipiramida
Jawaban : D
Pembahasan :
Konfigurasi elektron kulit utama
₇N = 2 . 5
₁H = 2
Atom N membutuhkan 3 elektron untuk mencapai kestabilan oktet.
Atom H membutuhkan 1 elektron untuk mencapai kestabilan duplet.
Pada senyawa amonia atau NH₃, atom N bertindak sebagai atom pusat yang berikatan dengan 3 buah atom H. Sebagai sesama non logam dan menggunakan elektron bersama, jenis ikatan yang terjadi adalah ikatan kovalen.
Setelah atom pusat N mencapai oktet, masih ada sepasang elektron bebas milik N. Perhatikan mekanisme selanjutnya.
Domain elektron ikatan atau disebut juga pasangan elektron ikatan (PEI) = 3. Terjadi antara atom pusat N yang berikatan 3 buah atom H.
Domain elektron bebas atau disebut juga pasangan elektron bebas (PEB) = 1, merupakan pasangan elektron bebas milik atom pusat N.
Antara sepasang elektron bebas atom pusat N dengan tiga pasang elektron ikatan atom H terjadi interaksi tolak-menolak.
Tipe molekul adalah
A = atom pusat ⇒ N
X = pasangan elektron ikatan (PEI)
m = jumlah PEI ⇒ 3 (atau terikat dengan 3 atom H)
E = pasangan elektron bebas (PEB)
n = jumlah PEB ⇒ 1
Dengan demikian tipe molekulnya adalah
Bentuk molekulnya adalah trigonal piramida atau boleh disebut juga segitiga piramida.
Baca Juga : Soal Ikatan Kimia
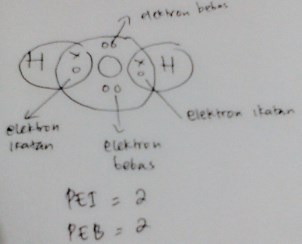
6. Jumlah PEI dan PEB molekul H2O (1H dan 8O) berturut-turut adalah …
A. 1 dan 2
B. 1 dan 3
C. 2 dan 1
D. 2 dan 2
E. 2 dan 3
Jawaban : D
Pembahasan :
H2O memiliki pasang elektron berikatan/PEI nya 2 dan pasangan elektron bebasnya 2 jadi tipe molekul nya adalah AX2E2
7. Nomor atom unsur X = 5 dan nomor atom unsur Y = 17, keduanya membentuk senyawa XY3. bentuk molekul senyawa tersebut adalah
a. linear
b. segitiga sama sisi
c. piramida trigonal
d. sudut
e. oktahedron
Jawaban : B
Bentuk molekul senyawa XY₃ adalah segitiga sama sisi (segitiga planar). Diawali dengan mengetahui konfigurasi elektron, kecenderungan untuk mencapai kestabilan, jumlah domain terikat dan bebas, serta tipe molekul.
Pembahasan :
Konfigurasi elektron berdasarkan kulit utama serta golongan dan periode
₅X = 2 . 3 ⇒ Golongan IIIA dan Periode 2
₁₇Y = 2 . 8 . 7 ⇒ Golongan VIIA dan Periode 3
Kita tentu masih ingat bahwa golongan ditentukan oleh banyaknya elektron pada kulit terluar sedangkan periode berdasarkan banyaknya kulit.
Jumlah elektron pada kulit terluar atau elektron valensi atom unsur X dan Y masing-masing adalah 3 dan 7.
Untuk atom unsur Y dibutuhkan 1 elektron untuk mencapai kestabilan atau keadaan oktet (8 elektron) pada kulit terluar.
Bagaimana dengan atom unsur X? Perhatikan, unsur X ini bukan termasuk logam melainkan metalloid. Pada tabel periodik, unsur X adalah boron (B) dan unsur Y adalah klor (Cl). Bila atom unsur bernomor 5 ini terlibat dalam suatu ikatan akan terdapat penyimpangan kaidah oktet.
Pada struktur Lewis senyawa XY₃, masing-masing tiga atom Y menangkap 1 elektron valensi milik atom pusat X agar mereka mencapai oktet/stabil. Sedangkan atom pusat X yang juga menggunakan 1 elektron dari masing-masing tiga atom Y belum genap mencapai oktet karena totalnya baru 6 elektron. Inilah yang disebut sebagai penyimpangan kaidah oktet.
8. Jika nomor atom S = 16 dan nomor atom F = 9, maka bentuk molekul SF4 adalah …
A. Segitiga datar
B. Bentuk V
C. Tetrahedral
D. Tetrahedral terdistorsi
E. Linear
Jawaban : C
Pembahasan :
Diketahui :
S = 2 8 6
F = 2 7
Dit : Type SF4 ?
Jawab
SF4 memiliki :
PEI = 4
PEB = 1
Jadi type molekulnya
AX4E1 (Tetrahedral)
9. Molekul di bawah ini yang memiliki sudut ikatan terbesar adalah …
A. H2O
B. NH₃
C. BF₃
E. IF₃
D. BeCl2
Jawaban : D
Pembahasan :
H2O = AX2E2 = 104,5 derajat
NH3= AX3E = 107,5 derajat
CH4 = Ax4 = 109,5 derajat
SF6= AX6 = 90 derajat
BeCl2= AX2 = 180 derajat
10. Sudut ikatan pada molekul H2O adalah 104,5 derajat , padahal pasangan-pasangan elektron menempati posisi ruang tetrahedron. hal ini disebabkan karena…
A. adanya 2 pasangan elektron bebas
B. adanya 2 pasangan elektron ikatan
C. pasangan elektron jauh dari atom pusat
D. adanya ikatan hidrogen pada H2O
E. adanya dipol permanen pada H2O
Jawaban : A
Pembahasan :
Sudut ikatan pada molekul H2O adalah 104,5 derajat , padahal pasangan-pasangan elektron menempati posisi ruang tetrahedron. hal ini disebabkan karena adanya 2 pasangan elektron bebas Elektron bebas disini membutuhkan space lebih besar (sudut lebih besar) dari elektron yang berikatan. Pada molekul H2O terdapat 2 PEB, Jadi sudutnya sebesar 104,5 derajat.
11. Suatu molekul mempunyai 5 pasangan elektron di sekitar atom pusat, dua diantaranya merupakan pasangan elektron bebas. Bentuk molekul tersebut yang paling mungkin adalah …
A. Segitiga datar
B. Tetrahedral
C. Segitiga piramida
D. Bentuk V
E. Bentuk T
Pembahasan :
Sudah selesai membaca dan berlatih soal menentukan bentuk molekul ini ? Ayo lihat dulu Daftar Soal Kimia lainnya






makasih banyak sangat membantu sekali
Terimakasih, sangat membantu
ambatukam