Oksigen adalah gas yang tidak berwarna dan tidak berbau. Itulah sebabnya mengapa kita sulit menemukannya. Pada tahun 1770-an, oksigen diproduksi dalam percobaan laboratorium. Bekerja secara independen, Carl Wilhelm Scheele di Swedia dan Joseph Priestley di Inggris merancang reaksi yang diperlukan. Scheele menghasilkan oksigen pertama, tapi Priestley adalah orang pertama yang mempublikasikan hasilnya. Akibatnya, Priestley biasanya dikreditkan atas penemuan oksigen.

Baik Scheele maupun Priestley mengklaim mereka telah menghasilkan jenis khusus dari udara. Mereka tidak menyadari bahwa mereka telah menemukan bukti dari elemen yang sebelumnya tidak diketahui. Pada tahun 1778, ilmuwan Perancis Antoine Lavoisier mereplikasi hasil temuan Priestley. Tapi Lavoisier menemukan cara yang berbeda untuk menjelaskannya.
Lavoisier mengumumkan ia telah mengidentifikasi elemen baru. Dan ia menamakannya “oksigen” dari kata-kata bahasa Yunani, Oxys dan genos, yang berarti “asam” dan “membentuk.” Lavoisier menyusun nama ini setelah ia menyadari bahwa senyawa yang kaya oksigen tertentu larut dalam air untuk memberikan asam. Ia menyimpulkan bahwa semua asam mengandung oksigen.
Lavoisier memang sempat salah dalam memahami peran oksigen dalam kimia asam. Tapi usahanya dengan oksigen menuntunnya untuk memperbaiki cara menjelaskan perubahan kimia. Lavoisier kemudian dikenal sebagai bapak kimia modern. Para ilmuwan yang mengikuti karyanya membantu mengembangkan pemahaman modern tentang atom.
Simak Juga : Unsur Nitrogen – Sifat Keberadaan di Alam, Pembuatan dan Kegunaan
Keberadaan Oksigen Di Alam
Oksigen atau zat asam adalah unsur kimia dalam sistem tabel periodik yang mempunyai lambang O dan nomor atom 8. Ia merupakan unsur golongan kalkogen dan dapat dengan mudah bereaksi dengan hampir semua unsur lainnya (utamanya menjadi oksida). Pada Temperatur dan tekanan standar, dua atom unsur ini berikatan menjadi dioksigen, yaitu senyawa gas diatomik dengan rumus O2 yang tidak berwarna, tidak berasa, dan tidak berbau. Oksigen merupakan unsur paling melimpah ketiga di alam semesta berdasarkan massadan unsur paling melimpah di kerak Bumi. Gas oksigen diatomik mengisi 20,9% volume atmosfer bumi.
Di alam, oksigen bebas dihasilkan dari fotolisis air selama fotosintesis oksigenik. Ganggang hijau dan sianobakteri di lingkungan lautan menghasilkan sekitar 70% oksigen bebas yang dihasilkan di bumi, sedangkan sisanya dihasilkan oleh tumbuhan daratan.
Semua kelompok molekul struktural yang terdapat pada organisme hidup, seperti protein, karbohidrat, dan lemak, mengandung oksigen. Demikian pula senyawa anorganik yang terdapat pada cangkang, gigi, dan tulang hewan. Oksigen dalam bentuk O2 dihasilkan dari air oleh sianobakteri, ganggang, dan tumbuhan selamafotosintesis, dan digunakan pada respirasi sel oleh hampir semua makhluk hidup.
Oksigen beracun bagi organisme anaerob, yang merupakan bentuk kehidupan paling dominan pada masa-masa awal evolusi kehidupan. O2 kemudian mulai berakumulasi pada atomsfer sekitar 2,5 miliar tahun yang lalu. Terdapat pula alotrop oksigen lainnya, yaitu ozon (O3). Lapisan ozon pada atomsfer membantu melindungi biosfer dari radiasi ultraviolet, namun pada permukaan bumi ia adalah polutan yang merupakan produk samping dari asbut.
Pembuatan Oksigen
Oksigen dapat dibuat dengan beberapa cara. Reaksi yang dapat menghasilkan oksigen ialah :
a) Penguraian katalitik hidrogen peroksida (pembuatan di laboratorium)
2 H2O2(l) + MnO2 → 2 H2O(l)+ O2
b) Penguraian termal senyawa yang mengandung banyak oksigen
- 2 KMnO4(s) → K2MNO4(s) + MnO2(s) + O2(g)
- 2 KClO3(s) → 2 KCl(s) + 3 O2(g)
- 2 KNO3(s) → 2 KNO2(s) + O2(g)
c) Reaksi antara perosida dan air
2 NaO2(s) +2 H2O(l) → 4 NaOH(aq) + O2(g)
Pembuatan oksigen secara komersial dapat dilakukan dengan cara:
- Destilasi bertingkat udara cair
- Elektrolisis air O2 yang diperoleh dengan cara elektrolisis sangat murni. Reaksi kseluruhan yang terjadi adalah:
2 H2O(l) → 2 H2(g) + O2(g)
d) Memanaskan serbuk kalium klorat KClO3 dengan katalisator mengan oksida (batu kawi) MnO2 sebagai katalis Reaksinya :
2KClO3(s) + MnO2 → 2KCl(s) + O2(g)
Simak Juga : 80+ Soal Kimia Unsur Pilihan Ganda dan Jawaban [+Pembahasannya]
Sifat – Sifat Oksigen
A. Sifat Fisika
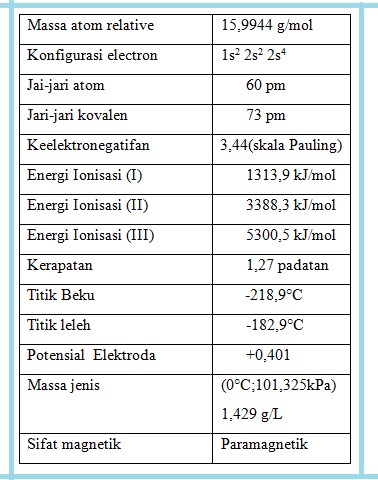
Oksigen adalah unsur yang sangat umum diantara unsur-unsur golongan 6 yang beranggotakan O, S, Se, Te,dan Po. Unsur ini mempunyai konfigurasi elektron s2p4 dalam tingkat energi yang tertinggi. Atom unsur ini dapat membentuk ikatan ion dan ikatan kovalen.
Sifat Kimia
Ada tiga isotop oksigen yang terdapat dialam 16O (99,76%), 17O (0,04%), dan 18O (0,2%) dengan bobot isotop per sma 16O 15,9949, 17O 16,9991, 18O 17,9992. oksigen merupakan unsur utama dalam kerak bumi yaitu merupakan kurang lebih 46,6% massa kerak bumi, 89% dalam air dan kira-kira 21% di atmosfir. Oksigen dengan konfigurasi elektron 1s2 2s2 2p4 dapat ,membentuk dua ikatan kovalen.
Suatu sifat khas yang jelas pada unsur-unsur grup VI A adalah, bahwa atom-atom mereka hanya memerlukan dua elektron lagi untuk mencapai konfigurasi s2 p6 dari gas mulia. Karena itu mereka sering bereaksi sebagai zat pengoksid dengan mencapai keadaan oksidasi -2. oksigen adalah zat pengoksid yang paling kuat.
Simak Juga : 40+ Soal Unsur Radioaktif (Radiokimia) Pilihan Ganda [+Pembahasan]
Reaksi Oksigen
1.) Reaksi logam dengan oksigen
Pembentukan oksida logam yang berasal dari reaksi antata logam dengan oksigen adalah kejadian biasa. Malah dalam bentik karatan merupakan asal kerugian ekoomi dalam dunia modern ini. Besi akan bereaksi dengan oksigen bila ada uap air membentuk karatan yaitu oksida besi yang kristalnya mengandung meleku;l air dalam jumlah beragam.
2Fe(s) + O2 (g) + xH2O(l) → Fe2O3.xH2O(s)
Alumunium, juga akan membentuk oksida bila bereaksi dengan oksigen di udara.
2Al(s) + O2(g) → Al2O3
Tetapi kadang-kadang reaksi antara logam dan oksigen dapat lebih cepat dan akan mengeluarkan banyak panas dan cahaya. Reaksi logam dengan oksigen semacam ini disebut pembakaran.
2.) Reaksi nonlogam dengan oksigen
Oksigen dapat juga bergabung secara langsung dengan kebanyakan nonlogam dan membentukoksida kovalen. Conth yang sudah kita kenala adalah reaksi O2 dengan karbon (dalam bentuk arang). Dengan adanya jumlah O2 berlebih maa hasilnya adalah karbon dioksida.
C(s) + 2O2(g) → CO2(g)
Bila oksigennya kurang, maka yang akan terbentuk adalah karbonmonoksida.
2C(s) + O2(g) → 2CO2(g)
Dua zat nonlogam lainnya yang mudah bereaksi dengan oksigen adalah belerang dan fosfor. Belerang bila dibakar d udara member warna nyala biru dan hasilnya sulfur oksida, suatu gas yang menyengar serta pengap.
S(s) + O2(g) → SO2(g)
Alotropi dari fosfor yaitu fosfor merah dan fosfor putih. Keduanya bila dibakar dalam oksigen menghasilkan P4O10, walaupun reaksi dari fosfor putih spontan. P4 akan terbakar sendiri bila diletakkan di udara.
P4(s) + 5O2(g) → P4O10(s)
Tak semua zat nonlogam dapat beraksi dengan oksigen, contohnya nitrogen. Karena itu udara kita yang merupakan campuran nitrogrn dan oksigen tetap stabil.
3.) Reaksi senyawa organik dengan oksigen
Senyawa organic pada umumnya adalah senyawa karbon. Senyawa organic yang paling sederhana disebut hidrokarbon, senyawa yang hanya terdiri dari karbon dan hydrogen. Hidrokarbon yang paling sederhana adalah metana, CH4. Metana dan hiodrokarbon lainnya mudah terbakar dalam udara. Bila tersedia oksigen yang cukup, hasil pembakarannya adalah karbon dioksidan dan air.
CH4 + 2O2 → CO2 + H2O
Tetapi, bila oksigen yang tersedia tidak cukup, hasilnya dapat mengandung karon monoksida.
2CH4 + 3O2 → 2CO + 4H2O
Sedangkan bila oksigennya sedikit sekali, maka hanya hydrogen yang bereaksi dengan oksigen membentuk air.
CH4 + O2 → C + 2H2O
Senyawa organic sering mengandung unsure-unsur tambahan selain karbon dan hydrogen. Bila mengandung oksigen, maka pada pembakaran menjadi CO2 dan H2O. misalnya pada pembakaran metal alcohol.
2CH3OH + 3O2 → 2CO2 + 3H2O
Kegunaan Oksigen
- Oksigen biasanya digunakan sebagai pengoksida, hanya fluorin mempunyai negatif elektron yang lebih tinggi.
- Dapat juga Oksigen sebagai bahan pengoksida dalam bahan api roket.
- Oksigen penting untuk pernafasan dan digunakan dengan meluas dalam bidang perubatan.
- Oksigen digunakan dengan meluas di kawasan yang kurang oksigen seperti pendaki gunung, juruterbang yang membawa bekalan oksigen tambahan.
- Senyawa oksigen Digunakan untuk pengimpalan dan dalam proses pembuatan besi dan metanol.
Oksigen merupakan satu unsur penting tubuh manusia, bersama-sama dengan hidrogen, karbon dan nitrogen. Tetapi, oksigen merupakan satu-satunya unsur yang diperlu setiap minit. Kesemua proses penting, seperti pernafasan, peredaran, fungsi otak, penghadaman, penyingkiran bahan buangan, pertumbuhan sel dan tisu, serta pembiakan hanya berlaku apabila terdapat banyak oksigen. Oksigen merupakan sumber tenaga yang segera bagi kebanyakan proses metabolisme dalam sel dan tisu.
Sebagian besar dari produksi oksigen digunakan pada industry baja. Besi tuag yang diperoleh dari tanur tinggi (besi kasar) mengandung karbon sekitar 3-4 %. Kadar karbon yang terlalu tinggi itu menyebabkan besi tuang kurang kuat dan rapuh. Kadar karbon dalam besi tuang dikurangi dengan oksidasi yang terkendali. Sebagian kecil oksigen digunakan bersama-sama dengan gas asetilen (etuna) untuk mengelas. Pembakaran gas asetilen bias mencapai suhu 3000C. Selain itu oksigen cair digunakan sebagai bahan bakar roket.
Senyawaan Oksigen
Oksigen dengan konfigurasi elektron [He] 2s2 2p4 adalah unsur yang sangat elektronegatif (skala paulling = 3,5), nomor dua terbesar seelah fluor (skala paulling = 4,1).
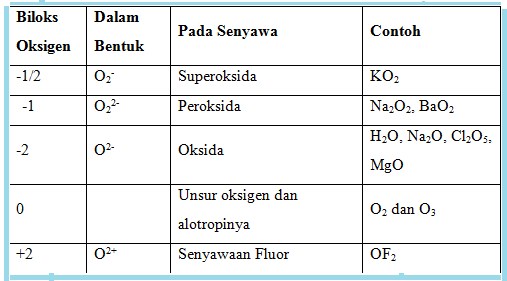
Oleh karena itu, semua unsur bereaksi dengan oksigen membentuk senyawa oksida, kecuali gas mulia. Selain itu, juga membentuk senyawa peroksida dan superoksida. Ini dimungkinkan karena oksigen dapat mempunyai bebrapa bilangan oksidasi, dalam senyawanya, seperti pada tabel berikut ini :
1.) Senyawa oksida
Ada 6 macam oksida, meskipun batas pengelompokan keenam kelompok oksida ini kadang-kadang tidak jelas.
Oksida asam
Oksida asam adalah oksida dari unsur nonlogam dan oksida unsur blok-d dengan bilangan oksidasi besar.
- SO3(g) + H2O(l) → 2H+(aq) + SO42-(aqa)
- CO2(g) + H2O(l) → 2H+(aq) + CO32-(aq)
- CrO3(s) + H2O(l) → 2H+(aq) + CrO42-(aq)
Oksida basa, yang dengan air membentuk basa
- CaO(s) + H2O(l) → Ca2+(aq) + 2 OH–(aq)
- Na2O(s) + H2O(l) → 2Na+(aq) + 2OH-(aq)
Oksida amfoter oksida ini dapat bereaksi denga asam maupun basa
- ZnO(s) + 2HCl(aq) → ZnCl2(g) + H2O(l)
- ZnO(s) + 2 OH–(aq) + H2O(g) → Zn(OH)42-(aq)
Oksida netral
Oksida ini tidak bereaksi dengan asam maupun basa, misalnya NO,N2O, dan CO
Oksida campuran
Oksida ini merupakan campuran dari oksida sederhana misalnya P3O4 merupakan campuran PbO (dua bagian) dan PbO2 (satu bagian).
2.) Senyawa Peroksida
Senyawa peroksida yang banyak digunakan adalah hydrogen peroksida H2O2, yaitu untuk pemutih pulp kertas, tekstil, kulit, lemak dan minyak rambut. Dalam industry digunakan sebagai pereaksi kimia organic, polimer, obat-obatan, dan produksi makanan. Hydrogen peroksida encer digunakan dalam rumah tangga untuk antiseptic ringan dan pemutih kain.
Hidrogen peroksida murni merupakan cairan tak berwarna yang membeku pada -0,46oC dan mendidih 150,2oC. Cairannya lebih kental dari pada air dengan massa jenisnya 1,44225 g/mL (pada 25oC). molekulnya menunjukan ikatan O-O
Hidrogen peroksida mempunyai nilai pKa = 11,75, bersifat asam sangat lemah dan sebagai proton akseptor, seperti ditunjukan dalam reaksi berikut ini :
H2O2 (aq) + H3O+(aq) → H2O(aq) + H3O+ (aq)
Namun demikian, hydrogen peroksida merupakan oksidator kuat dalam suasana asam maupun basa. Ini terlihat dari potensial reduksi standarnya :
- H2O2 (aq) + 2H+(aq) + 2e– 2 H2O E0=+1,77 V (1)
- O2(g) + 2H+(aq) + 2e– ↔ H2O2 (aq) E0=+0,69 V (2)
- HO2–(aq) + H2O + 2e– ↔ 3OH–(aq) E0=+0,87 V (3)
Laju reaksi Hidrogen peroksida mudah terurai menjadi air dan oksigen setelah disimpan lama. Reaksinya, sebagai berikut:
- 2 H2O2 (l) → 2 H2O + O2(g) ∆H= -197 kJ/mol
Penguraian ini dipercepat oleh adanya, panas , ion logam berat, dan kotoran. Bahkan air dan oksigen yang menjadi produk penguraiannya juga mempercepat proses penguraian selanjutnya.
3.) Senyawa Superoksida
Senyawa superoksida Na, K, dan Rb dibuat dari peroksidanya. Contohnya sebagai berikut:
K2O2 + O2→ 2KO2
Dalam sistem tertutup seperti pada kapal selam, kalium superoksida digunakan untuk menghilangkan gas karbon dioksida hasil pernafasan para kru kapal selam. Reaksinya sebagai berikut :
4 KO2 (s) + 2CO2 (g) ↔ 2K2CO3 (s) + 3O2 (g)
Reaksi diatas memungkinkan terjadinya regenerasi gas O2 yang diperlukan untuk pernafasan.
Superoksida ionik, MO2, dibentuk oleh interaksi O2 dengan K, Rb, atau Cs sebagai padatan Kristal kuning sampai jingga. NaO2 dapat diperoleh hanya dengan reaksi Na2O2 dengan O2 pada 300 atm dan 500°C.
LiO2 tidak dapat diisolasi. Superoksida alkali tanah, Mg, Zn, dan Cd hanya terdapat dalam konsentrasi kecil sebagai larutan padat dalam peroksida. Ion O2– mempunyai satu elektron tidak berpasangan. Superoksida adalah zat pengoksidasi yang sangat kuat. Mereka bereaksi kuat dengan air
- 2 O2– + H2O → O2 + HO2– + OH–
- 2 HO2– → 2OH– + O2 (lambat)
Reaksi dengan CO2, yang melibatkan intermediet peroksokarbonat, digunakan untuk menghilangkan CO2 dan meregenerasi O2 dalam system tertutup (misalnya kapal selam). Reaksi keseluruhan adalah
4MO2(s) + 2CO2(g) → 2M2CO3(s) + 3O2(g)
Ozon ( Trioksigen )
Ozon tertumpu di bawah stratosfer di antara 15 dan 30km di atas permukaan bumi yang dikenal sebagai ‘lapisan ozon’. Ozon terhasil dengan berbagai percampuran kimiawi, tetapi mekanisme utama penghasilan dan perpindahan dalam atmosfer adalah penyerapan tenaga sinar ultraviolet (UV) darimatahari.
Ozon adalah salah satu gas yang membentuk atmosfer. Molekul oksigen (O2) yang dengannya kita bernafas membentuk hampir 20% atmosfer. Pembentukan ozon (O3), molekul triatom oksigen kurang banyak dalam atmosferdi mana kandungannya hanya 1/3.000.000 gas atmosfer. Ozon adalah salah satu bentuk alotropi dari oksigen.
Ozon murni adalah gas berwarna biru muda dan berbau tajam ozon cair berwarna biru tua,sedangkan ozon paat berwarna ungu tua. Ozon cair mendidih pada -1800C. Ozon bersifat tidak stabil, baik daam bentuk gas, cair atau padat. Ozon cair mudah meledak.
Ozon adalah oksidator yang jauh lebih kuat daripada oksigen. Ozon mempnyai potensial reduksi standar yang sangat tinggi baik dalam suasana asam maupun basa. Hal ini mennjukkan bahwa ozon merupakan oksidator yang sangat kuat.
- O3(g) + 2H+(aq) + 2e– ↔ O2(g) + H2O E0 = + 2,08 V
- O3(g) + H2O + 2e– ↔ O2(g) + 2OH– E0 = + 1,24 V
Dalam suasana asam, kekuatan oksidator ozon urutan kedua setelah flour,sehingga ozon seringkali digunakan sebagai oksidator untuk pembuatan senyawa.Sifat oksidator ozon ini juga dimanfaatkan untuk mensterilkan air minum, karena dapat membunuh mikroorganisme.
Reaksi utama yang menghasilkan O3(g) pada stratosfer adalah :
- O2 + hv → O + O (a)
- O2 + O + M → O3 + M (b)
Penjelasan Persamaan
Persamaan (a) menjelaskan penguraian ozon setelah menyerap radiasiuv. Reaksi atom dan molekul O2 menghasilkan ozon seperti yang diuliskan pada persamaan (b).
M adalah ‘spesi ketiga’ (misalnya N2(g)) yang diperlukan untuk menangkap kelebihan energi tumbukkan. Adanya M sangat penting, karena ozon sangat energetic dan terurai spontan.
Penyerapan radiasi uv oleh molekul O3 disajikan pada persamaa (c). energy yang dibebaskan dalam reaksi (d) mengakiatkan efek keseimbangan panas diatmosfer bumi.
- O3 + hv → O2 + O …(c)
- O3 + O → 2O2 …(b)
Ozon (O3) dihasilkan apabila O2 menyerap sinar UV pada jarak gelombang 242 nanometer dan disingkirkan dengan fotosintesis dari sinar bagi jarak gelombang yang besar dari 290 nm. O3 juga merupakan penyerap utamasinar UV antara 200 dan 330 nm. Penggabungan proses-proses ini efektif dalam meneruskan ketetapan bilangan ozon dalam lapisan dan penyerapan 90% sinar UV.
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia



