Titrasi Redoks
Download File Titrasi redoks atau titrasi reduksi dan oksidasi untuk universitas dalam format (powerpoint) .ppt agar mudah dibaca dan tertata rapi lengkap.
Download Powerpoint Titrasi Redoks
Pengertian Titrasi Redoks
Secara umum Titrasi redoks merupakan suatu penetapan kadar reduktor atau oksidator berdasarkan reaksi oksidasi dan reaksi reduksi antara analit dengan titran, dimana redoktur akan teroksidasi dan oksidator akan tereduksi.
Jenis Titrasi Redoks
Berdasarkan perpindahan elektron antara titran dan analit. Jenis Titrasi Redoks yaitu :
1. Na2S2O3 sebagai titrant (Iodometri Tak Langsung).
2. I2 sebagai titrant (Iodometri Langsung/Iodimetri).
3. Suatu Oksidator kuat sebagai titrant terbagi :
a. KMnO4 (Permanganometri)
b. K2Cr2O7 (Dikhrometri)
c. Ce (IV) (Cerimetri)
4. Suatu Reduktor kuat sebagai titrant.
Iodium (I2)
Na2S2O3
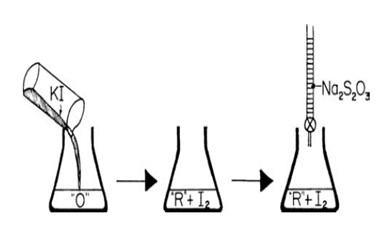
A. Titrasi Tidak Langsung (IODOMETRI)
Guna: untuk menetapkan senyawa-senyawa yang mempunyai potensial oksidasi yang lebih besar dari pada sistem iodium-iodida atau senyawa-senyawa yang bersifat oksidator, seperti CuSO4.5H2O.
Titrant: Na2S2O3
Analit: Suatu Oksidator
Analit yang bersifat oksidator direduksi dengan KI berlebihan (agen pereduksi) dan akan menghasilkan I2, yang selanjutnya dititrasi dengan larutan Na2S2O3 .
Indikator Amilum:
Amilum
Penambahan amilum ini harus menunggu sampai mendekati titik akhir titrasi ( bila I2 tinggal sedikit yang tampak dari warnanya yg kuning muda),
maksudnya ialah agar amilum tidak membungkus iodium dan menyebabkannya sukar lepas kembali.
B. Titrasi Langsung (IODIMETRI)
1. Permanganometri
Penetapan kadar reduktor atau oksidator dalam suasana asam sulfat encer dimana zat uji langsung dititrasi dengan KMnO4.
KMnO4
Oksidator kuat
Mudah diperoleh, tidak mahal
Auto indikator (tak perlu penambahan indikator)
Reaksi Reduksi dari KMnO4:
1. Dalam larutan sangat asam (>0,1 N H+)
MnO4– + 8H+ + 5e → Mn2+ + 4H2O E˚ = +1,51V
2. Pada suasana netral atau sedikit basa
MnO4– + 4H+ + 3e → MnO2↓ + 2H2O E˚ = +1,70V
3. Dalam suasana basa kuat (>0,1 N OH-)
MnO4– + e → MnO42- E˚ = +0,54V
Tes MnO42- : MnO42- + Ba2+ → BaMnO4↓ hijau
Pembuatan Larutan Standar KMnO4 :
- Larutkan kristal KMnO4 dalam air
4MnO4– + 2H2O → 4MnO2↓ + 3O2↑ + 4OH–
- Larutan dipanaskan, disaring untuk memisahkan MnO2.
- Filtrat distandarkan dengan larutan standar primer, exp: As2O3, Na2C2O4 dan Fe
- Larutan disimpan dalam botol coklat, bertahan selama 3 minggu, setelah 3 minggu harus distandarisasi kembali
Zat-zat standar primer untuk menstandarkan larutan KMnO4 :
As2O3 : Stabil, tak higroskopis, murni, mudah diperoleh :
As2O3 + 2NaOH → 2NaAsO2 + H2O
AsO2– + H+ → HAsO2
(As2O3 dilarutkan dalam larutan NaOH, lalu diasamkan dengan HCl)
Reaksi dengan KMnO4 :
5HAsO2 + 2MnO4– + 6H+ + 2H2O → 2Mn2+ + 5H3AsO4
Reaksi ini lambat, agar reaksi cepat tambah katalis
Na2C2O4 : murni, stabil, tak higroskopis
Reaksi:
5H2C2O4 + 2MnO4– + 6H+ → 2Mn2+ + 10CO2 + 8H2O
Lambat pada suhu kamar.
Cepat pada 60˚C + auto-katalis Mn22+
Fe(besi) murni: standar primer
Fe + 2HCl → Fe2+ + 2Cl– + 2H+
(besi dilarutkan dalam HCl)
Reaksi dengan KMnO4 dalam suasana asam:
5Fe2+ + MnO4– + 8H+ → 5Fe3+ + Mn2+ + 4H2O
Tetapi ion Cl- dapat ikut teroksidasi oleh KMnO4: lambat pada 25˚C,adanya ion Fe2+ mempercepat laju reaksi oksidasi Cl- tersebut sehingga terjadi pemakaian titrant berlebih.
2MnO42- + 16H+ + 10Cl- → 2Mn2+ + 5Cl2 + 8H2O
Bila dalam larutan yang dititrasi dengan KMnO4 ada ion Cl- tambahkan larutan Zimmermann Reinhardt
Keterangan:
Zimmermann-Reinhardt
(300g MnSO4.4 H2O, 400 ml H2SO4 pekat, 400 ml H3PO4 85% lalu encerkan menjadi 3 liter.
MnSO4 menurunkan EMnO4-/Mn2+, mengurangi kemungkinan oksidasi Cl-
H3PO4 menurunkan EFe3+/Fe2+, menaikkan daya reduksi MnO4- oleh Fe2+ dan menurunkan kemungkinan reduksi KMnO4 oleh Cl- (ion fosfat membentuk kompleks dengan ion Fe3+).
Penggunaan Titrasi Permanganometri
Secara Langsung
Titrasi zat reduktor:
1. Ion oksalat: C2O42- → 2CO2 + 2e
2. Arsenit: HAsO2 + 2H2O → H3AsO4 + 2H+ + 2e
3. Besi(II) : Fe2+ → Fe3+ + e
4. Antimonit: HSbO2 + 2H2O → H3SbO4 + 2H+ + 2e
5. H2O2 : H2O2 → O2 + 2H+ + 2e
6. Br- : 2Br- → Br2 + 2e
Menetapkan kadar H2O2
1 ml H2O2, diencerkan sampai 100 ml dalam labu ukur.
Ambil 20 ml larutan ini, tambahkan 20 ml H2SO4 2N, titrasi dengan KMnO4 0,1 N sampai terbentuk warna pink permanen pertama kali.
Secara Tak Langsung
1. Penetapan logam-logam yang membentuk endapan dengan ion oksalat(C2O42-):
Ca2+; Mn2+;Zn2+;Co2+;Ba2+;Pb2+
Penetapan Ca2+:
Ca2+ + C2O42- → CaC2O4↓putih disaring, dicuci
CaC2O4 dilarutkan dengan H2C2O4
CaC2O4 + 2H+ → Ca2+ + H2C2O4
H2C2O4 dititrasi dengan KMnO4
C. CERIMETRI
Titrasi Cerimetri
Cerium (IV) adalah zat pengoksid yang sangat kuat.
Ce4+ tereduksi menjadi Ce3+
Ce4+ + e → Ce3+
Kuning tak berwarna
- Keuntungan dibandingkan dengan KMnO4:
– Larutan Cerium(IV) sangat stabil.
– Hasil reduksi yang terjadi hanya satu
– Tidak dapat mengoksidasi ion klorida
Titrasi Fe2+ dengan Ce4+ dengan indikator: ferroin dalam suasana asam.
Titik akhir ditunjukkan oleh perubahab warna dari pink (merah muda) menjadi kuning muda.
Reaksi:
Ce4+ + e → Ce3+
Fe2+ → Fe3+ + e
Ce4+ + Fe2+ → Ce3+ + Fe+3
D. DIKHROMETRI
Titrasi Dikhrometri
Kalium dikhromat K2Cr2O7 adalah oksidator yang lebih lemah dari KMnO4
Larutannya: stabil, sebagai alat standar primer
Digunakan antara lain: dalam penetapan kadar besi (titrasi dengan besi dalam suasana asam) dengan indikator: natrium difenilamin sulfonat
Sebagai asam: H2SO4, HClO4, HCl
Titik akhir titrasi ditunjukkan oleh perubahan warna dari hijau menjadi ungu.