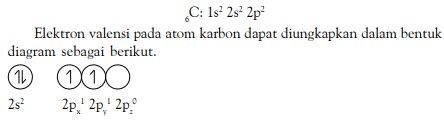Bagaimanakah bentuk dasar suatu molekul? Anda dapat menjawab pertanyaan-pertanyaan tersebut jika Anda mempelajari materi bentuk molekul ini dengan saksama.
Salah satu tujuan mempelajari ilmu Kimia adalah mengkaji tentang bagaimana partikel berukuran sangat kecil bergabung satu dengan lainnya membentuk struktur materi yang sangat besar seperti kita lihat sehari-hari, contohnya molekul air.
Materi yang kita amati sehari-hari sesungguhnya tersusun dari sejumlah partikel yang bergabung melalui ikatan kimia atau gaya antarmolekul. Dengan diketahuinya jenis ikatan yang memperkokoh partikel, diharapkan kita dapat meramalkan bentuk geometri suatu materi, khususnya geometri molekul.
A. Struktur Molekul Dasar
Walaupun jumlah materi di alam sangat banyak dan beragam, tetapi pada dasarnya materi tersebut dibangun oleh beberapa jenis atom dengan struktur yang terbatas. Jumlah cara penyusunan atom dalam molekul tidak banyak sebab dibatasi oleh sudut antarikatan dan sifat partikel penyusunnya.
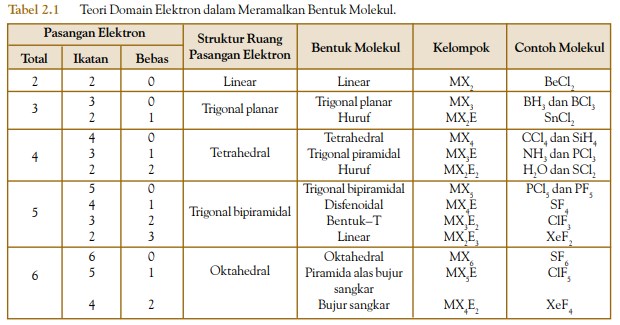
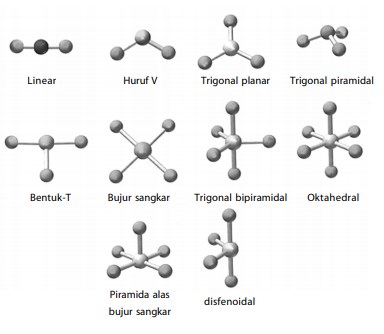
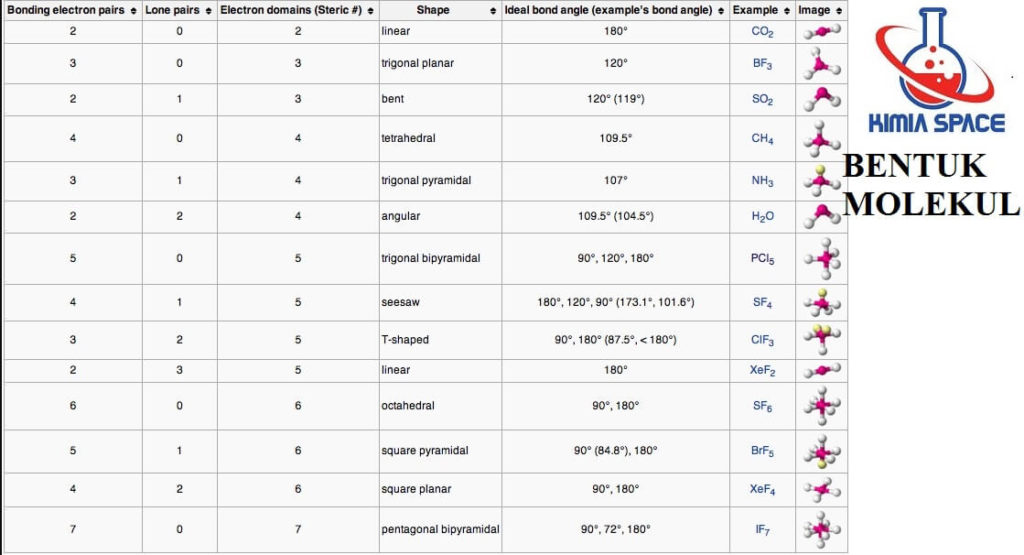
Teori yang mengkaji aspek struktur molekul adalah teori ikatan valensi (berdasarkan mekanika kuantum), teori domain elektron (berdasarkan teori Lewis), dan teori hibridisasi. Terdapat sekitar tujuh bentuk molekul yang sederhana, yaitu bentuk linear, trigonal planar, trigonal piramidal, segiempat datar, tetrahedral, tirogonal bipiramidal, dan oktahedral.
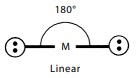
Bentuk Linear
Suatu molekul dikatakan linear jika atom-atom yang menyusun molekul tersebut berada dalam suatu garis lurus. Contohnya, BeCl2 dan CO2 . Sudut yang dibentuk oleh ikatan antara dua atom melalui atom pusat sebesar 180°.
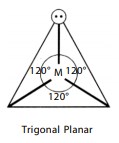
Trigonal Planar
Suatu bentuk molekul dikatakan trigonal planar jika di dalam molekulnya terdapat empat buah atom dan semua atom berada pada bidang yang sama. Atom pusat dikelilingi oleh tiga atom lain yang berada pada sudut-sudut segitiga. Sudut ikatan yang dibentuk di antara dua ikatan melalui atom pusat sama besar yaitu 120°. Contohnya, molekul BCl3 dan BF3 .
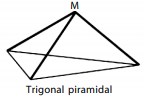
Trigonal Piramidal
Trigonal piramidal adalah suatu bentuk molekul dengan empat buah muka segitiga sama sisi. Suatu molekul dikatakan berbentuk trigonal piramidal jika memilki empat buah atom. Atom pusat ditempatkan pada sudut puncak limas, dan atom lainnya berada pada sudut-sudut limas yang berada pada bidang datar segitiga. Contohnya, molekul NH3 .
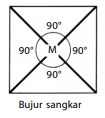
Bujur Sangkar
Suatu bentuk molekul dikatakan bujur sangkar jika dalam molekul terdapat lima buah atom dan semua atom berada pada bidang datar yang sama. Atom pusat dikelilingi oleh empat atom lain yang berada pada sudutsudut segiempat. Sudut ikatan yang dibentuk antara dua ikatan yang melalui pusat sama besar, yaitu 90°. Contohnya, molekul XeF4 .
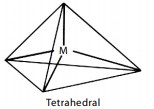
Tetrahedral
Tetrahedral adalah limas segiempat dengan muka segitiga sama sisi. Suatu bentuk molekul tergolong tetrahedral jika dalam molekulnya terdapat lima buah atom. Atom pusat ditempatkan pada pusat tetrahedral dan empat atom lain berada pada sudut-sudut tetrahedral yang terlihat pada ujung-ujung bidang segitiga sama sisi. Sudut ikatan yang dibentuk sama besar, yaitu 109,5°. Contohnya, molekul CH4.
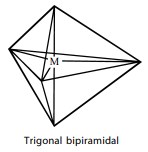
Trigonal Bipiramidal
Trigonal bipiramidal terdiri atas dua buah limas yang bagian alasnya berimpit. Suatu molekul memiliki bentuk trigonal bipiramidal jika dalam molekulnya terdapat enam buah atom.
Dalam trigonal bipiramidal, atom pusat ditempatkan pada pusat alas yang berimpit dan dikelilingi oleh lima atom lain yang ditempatkan pada sudut-sudut trigonal bipiramidal. Dalam bentuk molekul ini sudut ikatan tidak sama. Sudut ikatan yang terletak pada pusat bidang datar segitiga masing-masing 120°, sedangkan sudut ikatan antara bidang pusat dan titik sudut atas serta bawah bidang adalah 90°. Contohnya, molekul PCl5.
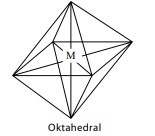
Oktahedral
Oktahedral adalah bentuk yang memiliki delapan muka segitiga, dibentuk dari dua buah limas alas segiempat yang berimpit. Suatu molekul memiliki bentuk oktahedral jika tersusun dari tujuh atom. Atom pusat ditempatkan pada pusat bidang segiempat yang berimpit. Enam atom lain terletak pada sudut-sudut oktahedral. Sudut antarikatan yang terbentuk sama besar, yaitu 90°. Contohnya, molekul SF6 dan XeF6
B. Teori Domain Elektron
Metode yang dapat digunakan untuk meramalkan bentuk molekul adalah model rumus titik-elektron yang diperluas menjadi teori domain elektron atau teori tolakan pasangan elektron kulit valensi (VSEPR, Valence Shell Electron Pair Repulsion). Seperangkat aturan dikemas ke dalam teori domain elektron yang memungkinkan Anda dapat meramalkan bentuk molekul secara tepat.
Teori ini didasarkan pada jumlah pasangan elektron ikatan dan pasangan elektron bebas dalam kulit valensi atom pusat suatu molekul. Teori ini menyatakan bahwa bentuk molekul dapat ditentukan berdasarkan tolakan pasangan elektron dalam kulit valensi atom pusat. Oleh karena itu, teori ini disebut teori domain elektron atau VSEPR.
Baca Juga : 10+ Soal Menentukan Bentuk Molekul (PEB dan PEI) [+Pembahasan]
Bagaimana teori ini dapat diterapkan untuk memprediksi bentuk suatu molekul? Untuk mempermudah mempelajarinya, molekul-molekul akan dikelompokkan ke dalam tiga kategori, yaitu molekul-molekul yang memiliki atom pusat:
- berikatan kovalen tunggal yang jenuh;
- berikatan kovalen tunggal yang tidak jenuh (memiliki elektron bebas);
- dan berikatan kovalen rangkap.
Bentuk Molekul Tanpa Elektron Bebas
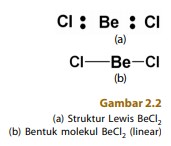
Simak molekul BeCl2 dengan menggunakan rumus Lewis yang ditunjukkan Gambar 2.2. Sebagai atom pusat adalah berilium dengan dua elektron valensi. Kedua elektron tersebut digunakan untuk berikatan kovalen dengan atom-atom klorin membentuk dua ikatan kovalen tunggal.
Pasangan elektron ikatan dalam kulit valensi atom pusat akan mengalami tolakan disebabkan muatannya sejenis. Guna meminimalkan tolakan tersebut maka pasangan elektron ikatan akan menjauh satu sama lain. Menurut pendapat Anda, pada posisi bagaimana tolakan akan minimal? Tolakan minimum dicapai jika pasangan elektron ikatan berada pada posisi dengan sudut 180°.
Oleh karena sudut ikatan yang terbentuk antara atom klorin dan atom klorin yang lain melalui titik pusat (atom Be) membentuk 180° maka bentuk molekul yang paling mungkin adalah linear.
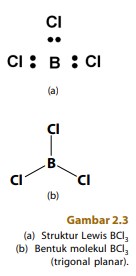
Sekarang, tinjau molekul dengan tiga pasang elektron ikatan dalam kulit valensi atom pusat. Contoh dari molekul ini adalah boron triklorida, BCl3 , rumus Lewisnya ditunjukkan Gambar 2.3a.
Tiga pasang elektron ikatan dalam kulit valensi atom pusat berusaha meminimalkan tolakan dengan cara memposisikan sejauh mungkin satu sama lain. Tolakan akan minimum jika ketiga pasang elektron ikatan berada pada posisi 120° satu sama lain.
Akibatnya, bentuk molekul yang terbentuk adalah trigonal planar dengan atom pusat berada di tengahtengah segitiga.
Sudah pahamkah Anda dengan dua contoh bentuk molekul pada Gambar 2.3? Jika belum paham, simak contoh penerapan teori domain elektron dalam bentuk molekul yang lain.
Molekul Kovalen Tunggal Tidak Jenuh
Molekul-molekul yang berikatan kovalen tunggal dan tidak jenuh adalah molekul-molekul dengan atom pusat yang memiliki pasangan elektron bebas atau tidak digunakan untuk berikatan. H2 O, NH3 , PCl3 , dan yang sejenis adalah contoh dari molekul jenis ini. Bagaimana meramalkan bentuk molekul yang memiliki pasangan elektron bebas (PEB)?
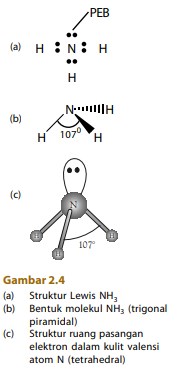
Simak molekul NH3 dengan atom pusat N dan memiliki 5 elektron valensi. Rumus Lewis molekul NH3 ditunjukkan oleh Gambar 2.4a. Pada atom N terdapat empat pasang elektron dalam kulit valensi. Tiga pasang merupakan pasangan elektron ikatan (PEI) dengan atom H dan satu pasang merupakan pasangan elektron bebas (PEB).
Antara keempat pasang elektron dalam kulit valensi atom N terjadi tolakan satu sama lain sedemikian rupa sehingga dicapai tolakan minimum antara pasangan elektron tersebut. Berdasarkan data empirik, diketahui bahwa molekul NH3 berbentuk limas alas segitiga dengan sudut ikatan 107° (Gambar 2.4b).
Bagaimana fakta ini dapat dijelaskan?
Oleh karena terdapat empat pasang elektron dalam kulit valensi atom N maka struktur ruang pasangan elektron yang paling mungkin adalah tetrahedral. Bentuk ini dapat diterima, seperti terlihat pada Gambar 2.4c. Akan tetapi, sudut ikatan dalam NH3 tidak sesuai dengan sudut tetrahedral, yakni 109°.
Molekul Kovalen Berikatan Rangkap
Bagaimanakah pandangan teori domain elektron terhadap molekul yang memiliki ikatan kovalen rangkap dua atau rangkap tiga? Menurut teori domain elektron, ikatan rangkap dianggap sebagai satuan gugus elektron seperti halnya ikatan tunggal yang menghubungkan atom dengan atom pusat M.
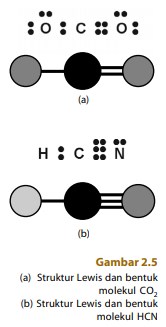
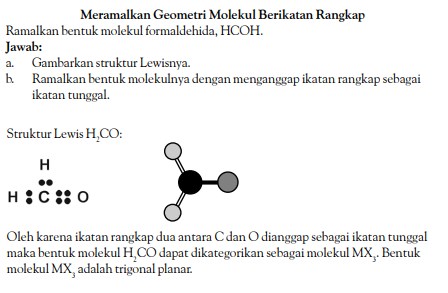
Contohnya, molekul CO2 yang mengandung ikatan rangkap dua. Menurut teori domain elektron, bentuk molekul CO2 dapat dianggap sebagai dua gugus pasangan elektron ikatan, seperti pada molekul BeCl2 . Oleh karena itu, bentuk molekul CO2 dianggap linear (perhatikan Gambar 2.5a).
Contoh molekul lain dengan ikatan rangkap tiga adalah HCN. Pada molekul HCN ada dua gugus pasangan elektron pada atom pusat C, yaitu pasangan elektron ikatan dengan H dan tiga pasangan elektron ikatan dengan N (ikatan rangkap tiga) sehingga diramalkan memiliki bentuk molekul linear (perhatikan Gambar 2.5b).
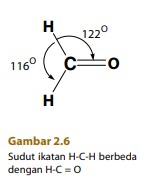
Berapakah sudut ikatan yang terbentuk dalam molekul formaldehida pada Contoh 2.3? Tentu Anda akan menduga 120° sebab bentuk molekulnya trigonal planar. Walaupun ikatan rangkap diperlakukan sebagai satu gugusan elektron seperti ikatan tunggal, tetapi ikatan rangkap memiliki kerapatan muatan elektron lebih tinggi daripada ikatan tunggal.
Akibatnya
tolakan ikatan rangkap terhadap ikatan tunggal lebih kuat dan berdampak pada sudut ikatan. Kekuatan tolakan ikatan rangkap serupa dengan PEB sehingga sudut ikatan H–C–H dalam molekul H2CO tidak sama besar dengan sudut ikatan H–C = 0. Hasil kajian menunjukkan sudut ikatan sebesar 116° dan 122° (lihat Gambar 2.6).
Berdasarkan uraian tersebut, dapatkah Anda menyimpulkan teori domain elektron dalam memprediksi struktur molekul? Andaikan M menyatakan atom pusat, X menyatakan atom yang terikat pada atom pusat, dan pasangan elektron bebas dinyatakan dengan E maka rumus bentuk molekul dapat diungkapkan sebagai MXmEn , dengan m adalah jumlah ligan dan n adalah jumlah pasangan elektron bebas dalam kulit valensi atom pusat.
Berdasarkan rumusan tersebut, Anda dapat menyatakan molekul dengan rumusan tersebut. Contohnya, CH4 sebagai MX4 , NH3 sebagai MX3E, dan H2O sebagai MX2E2 . Hasil-hasil yang dicapai dengan teori domain elektron dalam meramalkan bentuk molekul untuk molekul-molekul berikatan tunggal dan rangkap disajikan pada
Tabel 2.1 berikut.
Bentuk molekul berdasarkan teori domain elektron
C. Teori Ikatan Valensi dan Hibridisasi
Teori domain elektron sangat bermanfaat untuk meramalkan bentuk molekul sederhana, tetapi teori tersebut tidak menjelaskan bagaimana elektron-elektron dalam kulit terluar dari atom pusat dapat membentuk struktur tertentu. Untuk mengetahui hal ini dapat dijelaskan dengan hibridisasi orbital atom sebagai implementasi dari teori ikatan valensi.
Prinsip Umum Teori Ikatan Valensi
Menurut teori ikatan valensi, ikatan akan terbentuk antara dua atom jika memenuhi syarat sebagai berikut.
- Ketika membentuk ikatan, orbital-orbital pada atom pusat mengadakan restrukturisasi melalui proses hibridisasi membentuk orbital hibrida. Selanjutnya, orbital hibrida ini berikatan dengan orbital atom lain
- Orbital-orbital yang berikatan harus bertumpang tindih (overlapping) satu sama lain.
- Jumlah elektron dalam orbital ikatan yang bertumpang tindih maksimal dua elektron dengan spin berlawanan.
- Kekuatan ikatan bergantung pada derajat tumpang tindih. Semakin besar daerah tumpang tindih, semakin kuat ikatan yang terbentuk.
- Orbital-orbital atom selain orbital-s dalam berikatan memiliki arah tertentu sesuai orientasi orbital atom yang berikatan
Hibridisasi Orbital Atom
Apakah yang dimaksud dengan hibridisasi? Hibridisasi adalah proses pencampuran orbital-orbital atom membentuk orbital baru dengan tingkat energi berada di antara orbital-orbital yang dicampurkan. Orbital hasil pencampuran dinamakan orbital hibrida.
Mengapa orbital-orbital berhibridisasi? Untuk dapat menjawab hal ini, tinjau molekul CH4 yang dibentuk dari satu atom karbon dan empat atom hidrogen dihubungkan dengan konfigurasi elektron atom karbon. Konfigurasi elektron atom karbon dengan nomor atom 6 sebagai berikut.
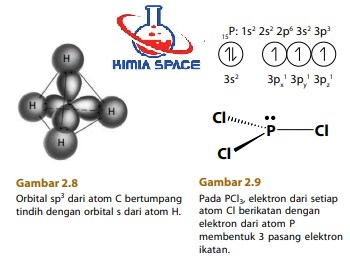
Jika Anda perhatikan konfigurasi elektron valensi tersebut, atom karbon hanya memiliki 2 elektron yang tidak berpasangan. Seharusnya, atom karbon maksimal mengikat 2 atom hidrogen membentuk CH2 , seperti pada molekul PCl3 (Gambar 2.9).
Perhatikan Gambar 2.8. Mengapa atom karbon dapat membentuk empat ikatan kovalen dengan atom-atom lain? Kasus ini dan untuk semua molekul yang lain dapat dijelaskan dengan pendekatan hibridisasi.
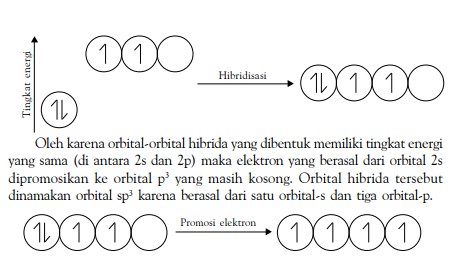
Oleh karena tingkat energi orbital 2s dan 2p tidak berbeda jauh maka dimungkinkan orbital-orbital tersebut berhibridisasi membentuk orbital yang baru ketika akan membentuk ikatan dengan atom-atom lain. Bagaimana proses terjadinya hibridisasi orbital-orbital pada atom pusat? Simak kembali molekul CH4 .
Ketika atom hidrogen mendekati atom karbon, terjadi perubahan tingkat energi orbital-orbital pada atom karbon sedemikian rupa sehingga dimungkinkan terjadinya hibridisasi orbitalorbital valensi atom karbon.
Dalam proses hibridisasi, berlaku hukum kekekalan orbital. Artinya jumlah orbital sebelum dan sesudah dicampurkan sama. Jadi, hibridisasi satu orbital-s dan tiga orbital-p akan terbentuk empat orbital sp3 .
Bentuk Molekul dan Valensi Terarah
Menurut teori ikatan valensi, pada pembentukan ikatan, orbitalorbital hibrida dari atom pusat harus bertumpang tindih dengan orbital atom lain dengan arah tertentu.
Pada molekul CH4 , orbital hibrida sp3 dari atom karbon akan bertumpang tindih dengan orbital-s dari atom hidrogen membentuk ikatan terlokalisasi sp3 –s sepanjang sumbu ikatan C–H. Oleh karena ikatan yang terbentuk memiliki orientasi tertentu dalam ruang maka ikatan ini disebut ikatan valensi terarah.
Bentuk molekul yang dibangun oleh CH4 ditentukan oleh orientasi orbital hibrida sp3 dalam atom karbon. Dengan kata lain, bentuk molekul ditentukan oleh struktur orbital hibrida pada atom pusat. Mengapa orbital hibrida memiliki struktur? Selain orbital-s, orbital-p dan orbital-d memiliki orientasi tertentu dalam ruang.
Orbital-orbital hibrida yang terbentuk dari orbital-orbital atom juga memilki struktur tertentu di dalam ruang. Jenis orbital hibrida yang dapat dibentuk dari kombinasi orbital s, p, dan d adalah orbital hibrida sp, sp2 , sp3 , dsp3 , sp3 d2 , atau d2 sp3 . Orbitalorbital tersebut memiliki orientasi tertentu dalam ruang.
a. Struktur Linear
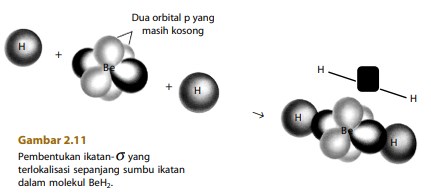
Struktur molekul BeH2 menurut prediksi teori domain elektron adalah linear. Bagaimana menurut pandangan teori ikatan valensi dengan pendekatan hibridisasinya? Atom pusat pada molekul BeH2 adalah berilium dengan konfigurasi elektron 4 Be: 1s2 2s2 2p0 .
Jika dilihat dari konfigurasi elektronnya, atom Be tidak memiliki elektron yang tidak berpasangan. Jadi, tidak mungkin dapat berikatan membentuk molekul, tetapi faktanya atom Be dapat membentuk molekul BeH2 .
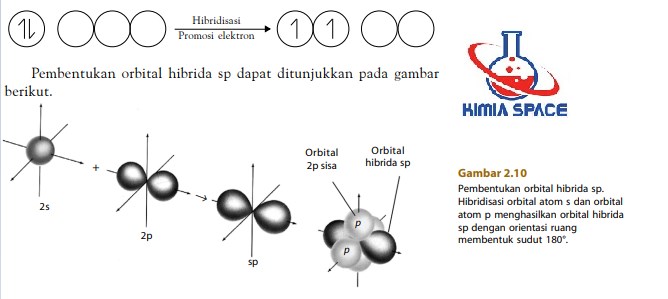
Agar atom Be dapat berikatan dengan atom H maka orbitalorbital 2s pada kulit valensi mengadakan hibridisasi dengan orbital 2p yang masih kosong, diikuti promosi elektron dari orbital 2s ke orbital 2p. Hasilnya adalah
Orbital hibrida sp memiliki dua aspek penting, yaitu:
- Setiap orbital menyediakan daerah tumpang tindih yang cukup besar dengan orbital 1s dari atom hidrogen.
- Orbital-orbital tersebut memiliki orientasi 180° satu sama lain. Dua orbital 2p yang tidak digunakan membentuk orbital hibrida berada pada posisi tegak lurus satu sama lain terhadap sumbu yang dibentuk oleh orbital hibrida sp.
Setiap orbital hibrida sp dalam atom Be bertumpang tindih dengan orbital 1s dari atom H membentuk dua orbital ikatan terlokalisasi yang setara (lihat Gambar 2.11). Setiap ikatan Be–H dalam molekul BeH2 disebut ikatanσ (sigma) dan struktur molekul yang terbentuk adalah linear
b. Struktur Trigonal Planar
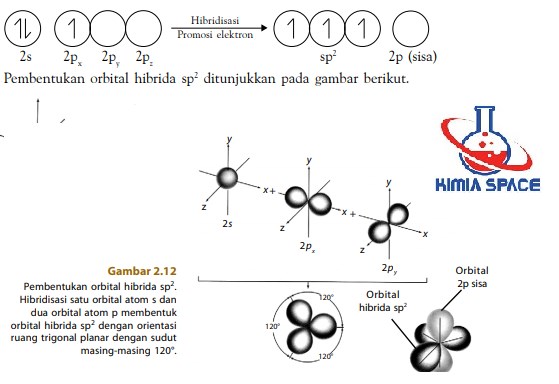
Molekul BF3 menurut teori domain elektron memiliki bentuk molekul trigonal planar. Bagaimana menurut pandangan teori ikatan valensi berdasarkan pendekatan hibridisasinya?
Atom pusat pada molekul BF3 adalah boron dengan konfigurasi elektron 5 B: 1s2 2s2 2p1 . Jika dilihat dari konfigurasi elektronnya, atom B memiliki satu elektron yang tidak berpasangan.
Jadi, hanya satu ikatan yang dapat dibentuk dengan atom F, tetapi faktanya atom B dapat mengikat tiga atom fluorin membentuk molekul BF3 . Agar atom B dapat berikatan dengan tiga atom F maka orbital-orbital 2s pada kulit valensi mengadakan hibridisasi dengan orbital 2p, diikuti promosi elektron dari orbital 2s ke orbital 2p. Hasilnya adalah sebagai berikut.
Untuk membentuk tiga ikatan yang setara, atom boron harus menyediakan tiga orbital setengah penuh. Hal ini dapat dicapai melalui hibridisasi orbital 2s dan dua orbital 2p membentuk orbital hibrida sp2 . Oleh karena ketiga orbital setara maka struktur yang terbentuk trigonal planar yang simetri. Masing-masing elektron valensi dalam orbital hibrida sp2 tidak berpasangan dengan spin sejajar (aturan Hund).
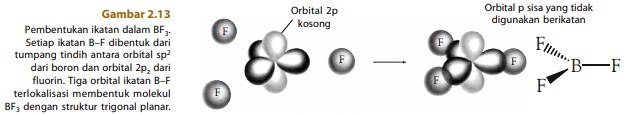
Molekul BF3 dibentuk melalui tumpang tindih orbital hibrida sp2 dari boron dan orbital 2pz dari fluorin membentuk tiga orbital ikatan sigma terlokalisasi. Bentuk molekul BF3 yang terbentuk adalah trigonal planar, seperti ditunjukkan pada gambar berikut.
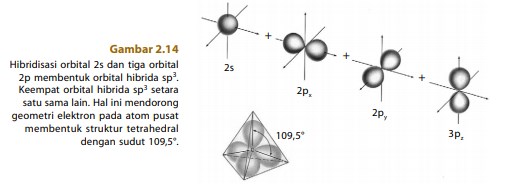
c. Struktur Tetrahedral
Orbital hibrida sp3 dapat dibentuk melalui kombinasi orbital s dan tiga orbital p. Orbital sp3 yang dibentuk ekuivalen dalam ukuran maupun tingkat energinya. Akibatnya, keempat orbital hibrida sp3 membentuk tetrahedral yang simetris di sekitar atom pusat dan molekul yang dibentuk melalui orbital hibrida sp3 memiliki struktur tetrahedral. Orientasi orbital hibrida sp3 ditunjukkan pada Gambar 2.14 berikut
Oleh karena keempat orbital setara maka struktur yang terbentuk adalah tetrahedral. Masing-masing elektron valensi dalam orbital hibrida sp3 tidak berpasangan dengan spin sejajar (aturan Hund).
Molekul CH4 dibentuk melalui tumpang tindih orbital hibrida sp3 dari atom C dan orbital 1s dari atom H membentuk empat orbital ikatan sigma terlokalisasi. Bentuk molekul CH4 adalah tetrahedral, sama seperti struktur orbital hibrida sp3 (lihat Gambar 2.15).
Sebagaimana diramalkan oleh teori domain elektron, bentuk molekul CH4 tetrahedral dan keempat ikatan C–H setara. Keempat orbital ikatan terlokalisasi dalam CH4 dibentuk melalui tumpang tindih orbital sp3 dan orbital 1s dari atom hidrogen.
d. Struktur Trigonal Bipiramidal dan Oktahedral
Struktur trigonal bipiramidal dan oktahedral merupakan kasus menarik dalam teori ikatan valensi dengan hibridisasinya. Orbital hibrida yang terbentuk melibatkan orbital-d dan senyawa yang terbentuk tergolong superoktet. Contoh molekul dengan bentuk trigonal bipiramidal adalah PCl5 dan contoh molekul oktahedral adalah SF6 .
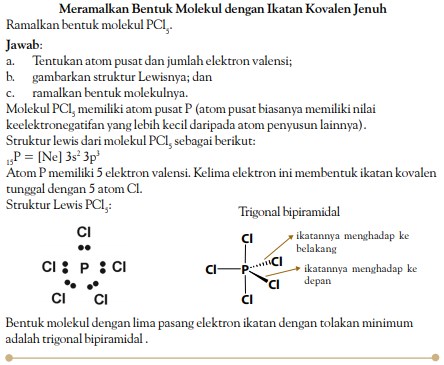
Tinjau molekul PCl5 dengan atom P sebagai atom pusat. Konfigurasi elektronnya: 15P: 1s2 2s2 2p6 3s2 3p3 3d0 . Hibridisasi satu orbital 3s, tiga orbital 3p dan satu orbital 3d menghasilkan lima orbital hibrida sp3 d dengan struktur trigonal bipiramidal yang simetris. Kelima orbital hibrida sp3 d memiliki sifatsifat menarik sebab ada dua orbital hibrida yang tidak setara.
Orbital-orbital hibrida sp3 d membentuk dua susunan yang tidak setara. Susunan pertama terdiri atas tiga orbital hibrida ekuilateral yang setara dan susunan kedua terdiri dari dua orbital aksial yang setara. Kelima orbital ikatan P–Cl dibentuk melalui tumpang tindih setiap orbital hibrida sp3 d dengan orbital 3p dari atom klorin.
Sepuluh elektron valensi menghuni lima orbital ikatan sigma terlokalisasi membentuk lima ikatan kovalen terlokalisasi. Pada struktur oktahedral diperlukan enam orbital dengan elektron tidak berpasangan. Keenam orbital tersebut dibentuk melalui hibridisasi 1 orbital s, 3 orbital p, dan 2 orbital d membentuk orbital hibrida sp3 d2 . Pada molekul SF6 , orbital pada kulit valensi atom S mengadakan hibridisasi membentuk orbital hibrida sp3 d2 dengan struktur oktahedral.
Keenam orbital sp3 d2 bertumpang tindih dengan orbital 2p dari atom fluorin membentuk enam ikatan S–F terlokalisasi yang setara dengan struktur oktahedral.
Untuk Menambah wawasan siswa silahkan download buku kimia melalui link dibawah ini :