Ikatan Kimia – Jenis Ikatan, Gaya Antar Molekul dan Geometri Molekul – Secara umum Ikatan kimia adalah sebuah proses fisika yang bertanggung jawab dalam interaksi gaya tarik menarik antara dua atom atau molekul yang menyebabkan suatu senyawa diatomik atau poliatomik menjadi stabil. Penjelasan mengenai gaya tarik menarik ini sangatlah rumit dan dijelaskan oleh elektrodinamika kuantum.
Dalam prakteknya, para kimiawan biasanya bergantung pada teori kuantum atau penjelasan kualitatif yang kurang kaku (namun lebih mudah untuk dijelaskan) dalam menjelaskan ikatan kimia. Secara umum, ikatan kimia yang kuat diasosiasikan dengan transfer elektron antara dua atom yang berpartisipasi. Ikatan kimia menjaga molekul-molekul, kristal, dan gas-gas diatomik untuk tetap bersama. Selain itu ikatan kimia juga menentukan struktur suatu zat.
Lihat Juga : 50+ Soal Ikatan Kimia Pilihan Ganda [+ Pembahasan Lengkap]
1. Pengertian Ikatan Kimia
Ikatan kimia adalah gaya tarik menarik yang kuat antara atom-atom tertentu bergabung membentuk molekul atau gabungan ion-ion sehingga keadaannya menjadi lebih stabil. Dua atom atau lebih dapat membentuk suatu molekul melalui ikatan kimia. Ikatan kimia terjadi karena penggabungan atom-atom, yang membentuk molekul senyawa yang sesuai dengan aturan oktet
2. Jenis-Jenis Ikatan Kimia
Ikatan kimia merupakan sebuah proses fisika yang bertanggungjawab dalam gaya interaksi tarik menarik antara dua atom atau molekul yang menyebabkan suatu senyawa diatomik atau poliatomik menjadi stabil. Secara umum, ikatan kimia dapat digolongkan menjadi dua jenis, yaitu ikatan primer dan ikatan sekunder.
A. Ikatan Primer
Ikatan primer adalah ikatan kimia dimana ikatan gata antar atomnya relatif besar. Ikatan primer ini terdiri atas ikatan ion, ikatan kovalen, dan ikatan logam.
Ikatan ion
Ada beberapa definisi tentang ikatan ion, yaitu:
- Ikatan ion adalah ikatan yang terjadi akibat gaya tarik-menarik lantara ion positif dan ion negatif.
- Ikatan ion terjadi antara unsur logam dengan unsur nonlogam.
- Ikatan ion terjadi karena adanya serah terima elektron dari satu atom ke atom yang lain.
- Ikatan ion ini sangat stabil, khususnya bila menyangkut ion bervalensi ganda.
Ciri-ciri senyawa ionik:
- Mempunyai titik didih dan titik leleh tinggi.
- Gaya tarik menarik antarpartikel sangat kuat.
- Tidak dapat menghantarkan listrik karena ion-ion yang berada dalam kristal sulit bergerak.
Contoh Pembentukan Ikatan Ion
Natrium tergolong unsur logam dengan energi ionisasi yang relatif rendah. Artinya mudah melepas elektron. Di lain pihak, klorin adalah unsur nonlogam dengan daya tarik elektron yang relatif besar. Artinya klorin mempunyai kecenderungan besar untuk menarik elektron. Ketika natrium direaksikan dengan klorin, klorin akan menarik elektron dan natrium. Natrium berubah menjadi ion positif (Na+), sedangkan klorin berubah menjadi ion negatif (Cl-). Ion ion tersebut kemudian mengalami tarik-menarik karena gaya Coulomb sehingga membentuk NaCl.
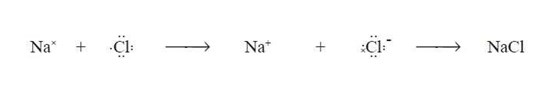
Rumus Kimia Senyawa Ion
Sesuai dengan aturan oktet, atom natrium akan melepas 1 elektron, sedangkan atom klorin akan menyerap 1 elektron. Jadi, setiap 1 atom klorin membutuhkan 1 atom natrium. Akan tetapi, tidak bisa diartikan bahwa satu ion Na+ hanya terikat pada satu ion Cl–.

Dalam kristal NaCl, setiap atom Na+ dikelilingi oleh 6 ion Cl– dan setiap ion Cl–dikelilingi oleh 6 ion Na+ dalam suatu struktur tiga dimensi berbentuk kubus. Rumus kimia NaCl adalah rumus empiris, menyatakan bahwa perbandingan ion Na+ dan Cl–adalah 1:1.
Ikatan kovalen
Ada beberapa definisi tentang ikatan kovalen, yaitu:
- Ikatan kovalen adalah ikatan kimia yang sangat kuat dimana gaya antar atomnya ditimbulkan dari penggunaan bersama elektron.
- Ikatan kovalen terjadi antara unsur nonlogam dengan unsur non logam, serta mempunyai perbedaan elektronegatifitas yang kecil.
- Ikatan kovalen terjadi karena pemakaian bersama elektron-elektron oleh dua atom.
- Ikatan kovalen terjadi antara unsur nonlogam dengan unsur nonlogam.
Contoh Pembentukan Ikatan Kovalen
Pembentukan ikatan dalam molekul H2 tidak melalui pelepasan dan penyerapan elektron. Sebagai unsur nonlogam, atom-atom hidrogen mempunyai daya tarik elektron yang cukup besar. Oleh karena peasangan elektron yang terbentuk ditarik oleh kedua inti atom hidrogen yang berikatan, kedua atom tersebut menjadi saling terikat. Ikatan yang terbentuk dengan cara penggunaan bersama pasangan elektron ini yang dimaksud dengan ikatan kovalen.
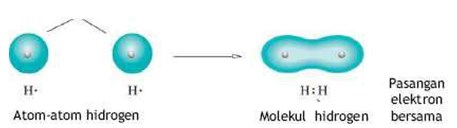
Rumus Kimia Senyawa Kovalen
Dengan mengacu pada aturan oktet, kita dapat memprediksikan rumus molekul dari senyawa yang berikatan kovalen. Dalam hal ini, jumlah elektron yang dipasangkan harus disamakan. Akan tetapi, perlu diingat bahwa aturan oktet tidak selalui dipatuhi, terdapat beberapa senyawa kovalen yang melanggar aturan oktet. Contohnya adalah ikatan antara H dan O dalam H2O. Konfigurasi elektron H dan O adalah H memerlukan 1 elektron dan O memerlukan 2 elektron. Agar atom O dan H mengikuti kaidah oktet,
jumlah atom H yang diberikan harus menjadi dua, sedangkan atom O satu, sehingga rumus molekul senyawa adalah H2O.
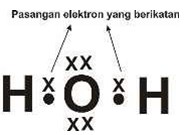
Struktur Lewis atau Rumus Struktur Senyawa Kovalen
Struktur Lewis adalah diagram yang menunjukkan ikatan-ikatan antar atom dalam suatu molekul. Struktur Lewis digunakan untuk menggambarkan ikatan kovalen dan ikatan kovalen koordinat. Cara atom-atom saling mengikat dalam suatu molekul dinyatakan dengan rumus bangun atau rumus struktur. Rumus struktur diperoleh dari rumus Lewis, setiap pasangan elektron ikatan pada rumus lewis digambarkan dengan sepotong garis.
Ikatan kovalen terdiri atas ikatan kovalen polar, kovalen non polar, dan kovalen koordinasi.
a. Kovalen polar
Senyawa kovalen dikatakan polar jika senyawa tersebut memiliki perbedaan keelektronegatifan. Dengan demikian, pada senyawa yang berikatan kovalen
terjadi pengutuban muatan. Ikatan kovalen polar adalah Pasangan Elektron Ikatannya (PEI) cenderung tertarik ke salah satu atom yang berikatan. Senyawa kovalen polar biasanya terjadi antara atom-atom unsur yang beda keelektronegatifannya besar, mempunyai bentuk molekul asimetris, mempunyai momen dipol.
b. Kovalen non polar
Senyawa kovalen dikatakan non polar jika senyawa tersebut tidak memiliki perbedaan keelektronegatifan.
Dengan demikian, pada senyawa berikatan kovalen tidak terjadi nonpolar adalah ikatan kovalen yang tertarik sama kuat ke arah atom-atom yang berikatan. Senyawa kovalen nonpolar terbentuk antara atom-atom unsur yang mempunyai beda keelektronegatifan nol atau mempunyai momen dipol = 0 (nol) atau mempunyai bentuk molekul simetri.
c.Kovalen koordinasi
Ikatan kovalen koordinasi adalah ikatan kovalen yang terbentuk dari pemakaian bersama elektron yang hanya disumbangkan oleh satu atom, sedangkan atom yang lainnya tidak menyumbangkan elektron. Ikatan ini dapat terjadi jika atom penyumbang memiliki Pasangan Elektron Bebas (PEB).
Contoh ikatan kovalen koordinasi adalah ammonia (NH3) yang bereaksi dengan boron triklorida (BCl3) membentuk senyawa NH3BCl3. Atom N dalam NH3 sudah memenuhi kaidah oktet dan mempunyai sepasang elektron bebas. Di lain pihak, atom B dalam BCl3 sudah memasangkan semua elektron valensinya, namun belum memenuhi kaidah oktet. Dalam hal ini, atom N (dari NH3) dan atom B (dari BCl3) dapat berikatan dengan menggunakan bersama pasangan elektron bebas dari atom N.
Ikatan Logam
Ada beberapa definisi tentang ikatan logam, yaitu:
- Ikatan logam adalah suatu kekuatan utama yang menyatukan atom-atom logam.
- Ikatan logam adalah ikatan kimia dimana gaya antar atomnya terbentuk karena penggunaan elektron bersama-sama tetapi tanpa memiliki arah yang tertentu.
- Ikatan logam merupakan akibat dari adanya tarik menarik muatan positif dari logam dan muatan negatif dari elektron yang bergerak bebas.
Ikatan logam terjadi karena adanya delokalisasi elektron. Sebagaimana telah diketahui bahwa unsur logam mempunyai sedikit elektron valensi sehingga kulit terluar atom logam relatif longgar. Kejadian seperti itu memungkinkan elektron valensi dapat berpindah-pindah.
Mobilitas elektron dalam logam sangat bebas, menyebabkan elektron dapat berpindah dari satu atom ke atom lain, atau disebut juga delokalisasi. Elektron-elektron valensi yang mengalami delokalisasi tersebut membentuk satu awan yang membungkus ion-ion positif logam di dalamnya.
B. Ikatan Sekunder (Gaya Tarik Antarmolekul)
Ikatan sekunder adalah ikatan antar molekul. Gaya ikatan sekunder timbul dari dipol atom atau molekul. Pada dasarnya dipol listrik timbul jika ada jarak pisah antara bagian positif dan negatif dari sebuah atom dan molekul. Perlu diingat bahwa gaya tarik antarmolekul berikatan dengan sifat-sifat fisis zat, seperti titik leleh dan titik didih. Semakin kuat gaya tarik antarmolekul, semakin sulit untuk memutuskannya, sehingga mengakibatkan semakin tinggi titik leleh maupun titik didih suatu senyawa.
Gaya London / Gaya Dispersi
Gaya London atau gaya dispersi adalah gaya tarik menarik antara molekul-molekul dalam zat yang nonpolar. Fritz London, seorang ilmuwan Jerman mengungkapkan teori tentang gaya ini, sehingga gaya ini bisa disebut gaya London. Gaya London adalah gaya dimana elektron senantiasa bergerak dalam orbital.
Perpindahan elektron dari suatu daerah ke daerah lainnya menyebabkan suatu molekul yang secara normal bersifat nonpolar menjadi polar sesaat, membentuk dipol sesaat. Dipol yang terbentuk dengan cara ini disebut dipol sesaat karena dipol ini dapat berubah secara banyak dalam satu detik. Dipol sesaat pada suatu molekul dapat mengimbas molekul di sekitarnya sehingga membentuk suatu dipol terimbas.
Gaya London merupakan gaya yang relatif lemah. Zat yng molekulnya bertarikan hanya berdasarkan gaya London mempunyai titik leleh dan titik didih yang rendah dibandingkan dengan zat lain yang massa molekulnya relatif kira-kira sama.
Jika molekul-molekulnya kecil, zat-zat itu biasanya berbentuk gas pada suhu kamar. Contohnya adalah hidrogen (H2), nitrogen (N2), metana (CH4), gas-gas mulia seperti helium (He), dan sebagainya.
Ikatan Hidrogen
Suatu gaya antarmolekul yang relatif kuat terdapat dalam senyawa hidrogen yang mempunyai keelektronegatifan besar, yaitu fluorin (F), oksigen (O), dan nitrogen (N). Misalnya dalam HF, H20, dan NH3. Hal ini tercermin dari titik didih yang menyolok tinggi dari senyawa-senyawa tersebut dibandingkan dengan senyawa lain yang sejenis.
Kekuatan ikatan hidrogen ini dipengaruhi oleh perbedaan elektronegativitas antara atom-atom dalam molekul tersebut. Semakin besar perbedaannya, semakin besar ikatan hidrogen yang terbentuk.
Ikatan hidrogen memengaruhi titik didih suatu senyawa. Semakin besar ikatan hidrogennya, semakin tinggi titik didihnya. Namun, khusus pada air (H2O), terjadi dua ikatan hidrogen pada tiap molekulnya. Akibatnya jumlah total ikatan hidrogennya lebih besar daripada asam florida (HF) yang seharusnya memiliki ikatan hidrogen terbesar (karena paling tinggi perbedaan elektronegativitasnya) sehingga titik didih air lebih tinggi daripada asam florida.
Ikatan / Gaya Van Der Waals
Gaya-gaya antarmolekul secara kolektif disebut juga gaya van der Waals. Jadi, bisa dikatakan bahwa gaya London, gaya dipol-dipol, dan gaya dipol-dipol terimbas, semuanya tergolong gaya van der Waals. Namun demikian, ada kebiasaan untuk melakukan pembedaan yang bertujuan untuk memperjelas gaya antarmolekul dalam suatu zat berikut.
- Istilah gaya London atau gaya dispersi digunakan, jika gaya antarmolekul itulah satu-satunya, yaitu untuk zat-zat yang nonpolar. Misalnya untuk gas mulia, hidrogen, dan nitrogen.
- Istilah gaya van der Waals digunakan untuk zat yang mempunyai dipol-dipol selain gaya dipersi, misalnya hidrogen klorida dan aseton
Simak Juga : 50+ Soal Ikatan Kimia Pilihan Ganda [+ Pembahasan Lengkap]
3. Geometri Molekul
Geometri molekul berkaitan dengan susunan ruang atom-atom dalam molekul. Molekul diatomik memiliki geometri linear; Molekul triatomik dapat bergeometri linear atau bengkok; Molekul tetraatomik bergeometri planar (datar sebidang) atau piramida. Semakin banyak atom penyusun molekul, semakin banyak pula geometrinya.
Geometri molekul dapat ditentukan melalui percobaan. Namun demikian, molekul-molekul sederhana dapat diramalkan geometrinya berdasarkan pemahaman tentang struktur elektron dalam molekul.
Teori Domain Elektron
Teori domain elektron adalah suatu cara meramaikan geometri molekul berdasarkan tolak-menolak elektron-elektron pada kulit luar atom pusat. Domain elektron berarti kedudukan elektron atau daerah keberadaan elektron, dalam hal ini pada atom pusat. Jumlah domain elektron ditentukan sebagai berikut.
- Satu pasangan elektron ikatan (PEI), baik ikatan tunggal, rangkap, atau rangkap tiga, merupakan satu domain.
- Satu pasangan elektron bebas (PEB) merupakan satu domain.
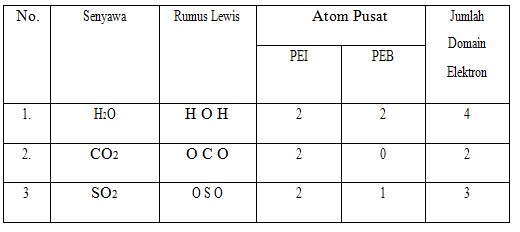
Prinsip Dasar Teori Domain Elektron
- Antara domain elektron pada kulit luar atom pusat saling tolak-menolak, sehingga domain elektron akan mengatur diri (mengambil formasi) sedemikian rupa sehingga tolak-menolak di antaranya menjadi minimum.
- Pasangan elektron bebas mempunyai gaya tolak yang sedikit lebih kuat daripada pasangan elektron ikatan. Hal itu terjadi karena pasangan elektron bebas hanya terikat pada satu atom sehingga gerakannya lebih leluasa.
Simak Juga : 50+ Soal Ikatan Kimia Pilihan Ganda [+ Pembahasan Lengkap]



