Kesetimbangan Kimia – Konsep, Pergeseran, Tetapan dan Aplikasinya – Di alam sekitar kita banyak terjadi reaksi-reaksi kimia, seperti fotosintesis. Fotosintesis adalah proses kimia yang mengubah karbon dioksida dan air menjadi karbohidrat dan oksigen, di mana reaksi ini berkataliskan klorofil dan menggunakan sinar matahari sebagai energi untuk reaksi.

Pada dasarnya, istilah kesetimbangan berhubungan dengan apa yang kita sebut ”keseimbangan kimia” akan tetapi, keseimbangan ini merupakan keseimbangan Mekanik. Ketika suatu reaksi kimia berlangsung dalam sebuah bejana yang mencegah masuk atau keluarnya zat-zat yang terlibat dalam reaksi tersebut.
Maka besaran-besaran (kuantitas-kuantitas) dari komponen-komponen reaksi tersebut berubah ketika beberapa komponen tersebut digunakan dan komponen lainnya terbentuk. Setelah komposisinya tetap selama sistem tersebut tidak terganggu, sehingga sistem tersebut kemudian di katakan berada dalam keadan kesetimbangan atau lebih sederhana ”berada dalam kesetimbangan” dengan kata lain, sebuah reaksi kimia berada dalam kesetimbangan ketika tidak ada kecenderungan kuantitas-kuantitas zat-zat peraksi dan zat hasil reaksi untuk berubah.
Simak Juga : 60+ Soal Kesetimbangan Kimia Pilihan Ganda & Jawaban [+Pembahasan]
1. Pengertian Kesetimbangan Kimia
Kesetimbangan kimia adalah ilmu yang mempelajari semua proses yang dapat berlangsung dua arah, artinya proses atau reaksi yang dapat balik. Keadaan kesetimbangan kimia diperlihatkan pada contoh dibawah ini :
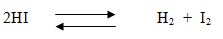
Reaksi kimia yang dapat berlangsung dalam dua arah yaitu dari reaktan ke produk dan produk dapat membentuk reaktan kembali. Reaksi kesetimbangan dinyatakan dengan dua tanda panah yang arahnya berlawanan. Reaksi ke kanan disebut reaksi maju dan reaksi ke kiri disebut reaksi balik.
- Reaksi maju : 2HI → H2 + I2
- Reaksi balik : H2 + I2 → 2HI
Reaksi maju lama kelamaan semakin lambat sebab jumlah pereaksi semakin berkurang, pada saat yang sama reaksi balik semakin cepat dengan makin bertambahnya jumlah hasil reaksi . Akhirnya pada suatu saat laju reaksi maju sama dengan laju reaksi balik, yang disebut keadaan setimbang atau kesetimbangan.
Baca Juga : 60+ Soal Kesetimbangan Kimia Pilihan Ganda & Jawaban [+Pembahasan]
2. Jenis Sistem Kesetimbangan
Terdapat 2 jenis sistem kesetimbangan kimia yaitu kesetimbangan homogen dan kesetimbangan heterogen.
Kesetimbangan Homogen
Tetapan kesetimbangan
Kesetimbangan homogen adalah suatu kesetimbangan yang hanya terdiri atas satu fasa atau reaksi dalam dimana semua spesies pereaksi ada dalam fase yang sama . Salah satu contoh kesetimbangan homogen yaitu :
H2O + I2 ↔ 2HI
2SO2 + O2 ↔ 2SO3
Gas A dan B bereaksi membentuk C dan D. Pada saat setimbang, kecepatan reaksi pembentuk gas C dan D adalah sama dengan pembentukan gas A dan B. Reaksi ini dapat dinyatakan dengan persamaan :
A(g) + B(g) ↔ C(g) + D(g)
V1 adalah kecepatan reaksi pembentukan gas C dan D. V2 adalah kecepatan reaksi pembentukan gas A dan B.
Pada saat setimbang :
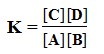
Harga K adalah tetap pada temperatur tertentu yang sama. Untuk reaksi pada temperatur tetap, secara umum dinyatakan dengan persamaan :
mA + nB ↔ pC + qD
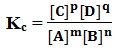
Hubungan Kp dan Kc
Persamaan keadaan gas ideal dapat ditulis sebagai berikut :
P = ( n/V ) RT
Karena ( n/V ) = konsentrasi (C), maka
P = CRT
Untuk reaksi
A(g) + B(g) ↔ C(g) + D(g)
Harga Kp menjadi :
Kp = Kc x (RT)∆n
Prinsip Le Chatelier
Seorang kimiawan berkebangsaan Perancis, pada tahun 1884, Henri Le Chatelier, menemukan bahwa
“Jika reaksi kimia yang setimbang menerima perubahaan keadaan (menerima aksi dari luar), reaksi tersebut akan menuju pada kesetimbangan baru dengan suatu pergeseran tertentu untuk mengatasi perubahan yang diterima (melakukan reaksi sebagai respon terhadap perubahan yang diterima)”.
Pergeseran Kesetimbangan
Faktor-faktor yang mempengaruhi kesetimbangan adalah :
A. Konsentrasi
Jika salah satu konsentrasi zat diperbesar, maka reaksi akan bergeser dari arah zat tersebut dan jika salah satu konsentrasi zat diperkecil maka reaksi akan bergeser ke arah zat tersebut.
Contoh Reaksi

Jika P ditambah berarti Konsentrasi P di-perbesar maka reaksi akan bergeser dari arah zat tersebut (P, kiri) menuju ke kanan sehingga jumlah R dan S yang terbentuk semakin bertambah.
Jika Q dikurangi berarti konsentrasi Q diperkecil maka reaksi akan bergeser kearah zat tersebut (Q, ruas kiri) atau menuju ke kiri sehingga R dan S yang terbentuk semakin sedikit.
B. Suhu
Jika suhu dinaikkan maka reaksi akan bergeser ke arah reaksi endoterm, dan jika suhu diturunkan maka reaksi akan bergeser ke arah reaksi eksoterm.
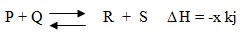
Jika suhu dinaikkan maka reaksi akan bergeser ke arah reaksi endoterm (kiri), sehingga R dan S (ruas kanan) yang terbentuk semakin sedikit, dan jika suhu diturunkan maka reaksi akan bergeser ke arah reaksi eksoterm (kanan) sehingga R dan S yang terbentuk semakin banyak .
C. Tekanan / Volume
Jika Tekanan dipebesar/volume diperkecil, maka reaksi akan bergeser ke arah jumlah mol gas yang lebih kecil, dan jika tekanan diperkecil/volume diperbesar maka reaksi akan bergeser ke arah jumlah mol gas yang lebih besar
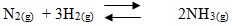
- Mol gas kiri = Koefisien (4)
- Mol gas kanan = koefisien (2)
Jika tekanan diperbesar (volume diperkecil) maka reaksi akan bergeser ke arah jumlah mol gas yang lebih kecil (kanan) sehinga NH3 yang terbentuk semakin banyak, sedangkan jika tekanan diperkecil (volume diperbesar) maka reaksi akan bergeser ke arah jumlah mol gas yang lebih besar (kiri) sehingga NH3 yang terbentuk semakin sedikit.
D. Katalis
Katalis hanya berfungsi untuk mempercepat tercapainya kesetimbangan kimia. Dalam suatu sistem kesetimbangan, suatu katalis menaikkan kecepatan reaksi maju dan reaksi balik dengan sama kuatnya. Suatu katalis tidak mengubah kuantitas relatif yang ada dalam kesetimbangan, nilai tetapan kesetimbangan tidaklah berubah. Katalis mempengaruhi laju reaksi maju sama besar dengan reaksi balik.
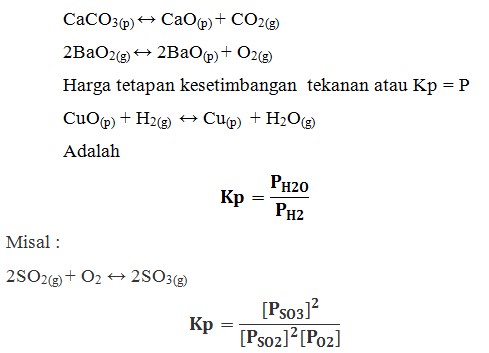
Kesetimbangan Heterogen
Sistem kesetimbangan heterogen adalah suatu sistem kesetimbangan yang komponen zatnya mempunyai fasa berbeda atau lebih dari satu.
Contoh
Kuantitas yang diperoleh melalui pemasukan harga konsentrasi awal spesies-spesies ke dalam pernyataan konstanta kesetimbangan disebut hasil bagi reaksi (Qc). Untuk menentukan arah pergeseran reaksi untuk mencapai kesetimbangan, kita harus membandingkan harga Qc dan Kc. Ada tiga kemungkinan yang dapat terjadi :
1. Qc > Kc harga perbandingan konsentrasi awal produk terhadap reaktan adalah cukup besar. Untuk mencapai kesetimbangan maka produk harus berubah menjadi reaktan. Proses berjalan dari ke kiri.
2. Qc = Kc konsentrasi mula-mula adalah sama dengan konsentrasi pada kesetimbangan berarti telah tercapai kesetimbangan.
3. Qc < Kc harga perbandingan konsentrasi awal produk terhadap reaktan adalah cukup kecil. Untuk mencapai kesetimbangan maka reaktan harus berubah menjadi produk. Proses berjalan dari ke kanan.
Lihat Juga : 60+ Soal Kesetimbangan Kimia Pilihan Ganda & Jawaban [+Pembahasan]
3. Tetapan Kesetimbangan
Jika hasil kali konsentrasi produk yang dipangkatkan koefisiennya dibandingkan dengan hasil kali konsentrasi reaktan yang dipangkatkan koefisienya, perbandingan itu senantiasa tetap.
Harga perbandingan yang tetap tersebut disebut tetapan kesetimbangan (konstanta kesetimbang-an), dengan lambang Kc atau sering ditulis K saja.
Suatu reaksi kesetimbangan dapat ditulis :
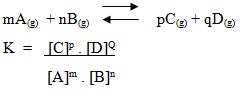
- Konsentrasi zat dinyatakan dengan satuan Molaritas (M)
- Yang dimasukkan dalam rumus K atau Kc hanya yang berwujud gas (g) dan zat ter-larut (aq) sebab zat tersebut memiliki konsentrasi yang tersebar merata dalam medium tempat dia berada, sedangkan zat padat (s) dan cairan (l) mereka dapat tidak tersebar merata
Derajat Dissosiasi (α)
Dalam reaksi kesetimbangan pereaksi di ruas kiri tidak pernah habis, oleh karena itu ruas kiri mempunyai harga yang menyatakan berapa bagian zat itu yang bereaksi atau terurai, yang disebut DERAJAT DISSOSIASI.

Tetapan kesetimbangan berdasarkan tekanan parsial
Suatu tekanan gas akan menimbulkan tekanan total (P) yang merupakan penjumlahan dari tekanan parsial masing-masing gas:
P = pa + pb + pc + ….
Pada reaksi :

4. Aplikasi Prinsip Kesetimbangan Kimia Dalam Industri
Pembentukan Amonia dengan proses Haber-Bosch
Proses Haber Bosch dalam bidang industri contohnya pada pembuatan amonia (NH3) merupakan senyawa nitrogen yang sangat penting bagi kehidupan, teutama sebagai bahan pembuatan pupuk dan sebagai pelarut yang baik untuk berbagai senyawa ionik dan senyawa polar. Amonia dibuat berdasarkan reaksi antara gas nitrogen dengan hidrogen.
Pembentukan Belerang Trioksida (SO3) pada proses kontak
2SO2(g) + O2(g) ↔ 2SO3(g) + 42.000 kal
Reaksi ini menyerupai sintesis amonia karena reaksi yang terjadi adalah eksoterm dan terjadi penurunan volume. Untuk mengatasi SO3 yang optimum operasi/reaksi dilakukan pada temperatur rendah, tekanan tinggi, dan gas oksigen atau SO2 berlebihan, tetapi proses tidak ekonomis karena laju reaksinya rendah.
Pembentukan Nitrogen Oksida ( Proses Birkland-Eyde )
N2 + O2(g) ↔ 2NO – 43.250 kal
Reaksi pembentukan NO merupakan reaksi eksoterm, maka jika temperatur dinaikkan, kesetimbangan akan bergeser ke arah penyerapan kalor atau ke arah reaksi endoterm. Dengan demikian, pembentukan NO akan bertambah pada kenaikan temperatur. Selain itu, hasil NO semakin bertambah bila gas N2 dan O2 berlebihan.
Pembuatan asam sulfat menurut proses kontak
Asam sulfat digunakan pada industri baja untuk menghilangkan karat besi sebelum baja dilapisi timah atau seng. Pada pembuatan zat warna, obat-obatan; pada proses pemurnian logam dengan cara elektrolisis; pada industri tekstil, cat, plastik, akumulator, bahan peledak, dan lain-lain. Pendeknya, banyaknya pemakaian asam sulfat di suatu negara telah dipakai sebagai ukuran kemakmuran negara tersebut.
5. Rangkuman
Kesetimbangan akan terjadi bila suatu reaksi kimia dapat berlangsung dua arah. Pada saat kesetimbangan tercapai, kecepatan reaksi ke kiri adalah sama dengan kecepatan reaksi ke kanan. Sistem kesetimbangan homogen terjadi bila dalam sistem terdapat satu fasa. Sedangkan jika fasa komponen zat lebih dari satu atau berbeda disebut kesetimbangan heterogen.
Kp atau Kc merupakan tetapan pada temperatur tertentu yang tetap dan hanya berlaku untuk gas. Dengan demikian, kesetimbangan reaksi dipengaruhi oleh konsentrasi, tekanan, volume, dan temperatur. Pengaruh konsentrasi, tekanan, volume, dan temperatur pada kesetimbangan dijelaskan menurut Le Chatelier, maka pada sistem akan timbul reaksi yang berusaha untuk menetralkan aksi tersebut, sehingga harga tetapan kesetmbangan tetap.
Pada kesetimbangan heterogen, apabila fas azat adalah padat dan gas, maka harga Kp hanya tergantung pada fasa gas, karena harga aktivitas zat padat adalah :
- Pengaruh konsentrasi
- tekanan, dan
- temperatur
Pada kesetimbangan heterogen adalah sama dengan pengaruhnya kesetimbangan homogen.
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia



