Termokimia – Entalpi, Sistem, Lingkungan dan Hukum kekekalan energi – Bagian dari ilmu kimia yang mempelajari perubahan kalor atau panas suatu zat yang menyertai suatu reaksi atau proses kimia dan fisika disebut termokimia. Secara operasional termokimia berkaitan dengan pengukuran dan pernafsiran perubahan kalor yang menyertai reaksi kimia, perubahan keadaan, dan pembentukan larutan.
1. Pengertian Termokimia
Termokimia merupakan pengetahuan dasar yang perlu diberikan atau yang dapat diperoleh dari reaksi-reaksi kimia, tetapi juga perlu sebagai pengetahuan dasar untuk pengkajian teori ikatan kimia dan struktur kimia. Fokus bahasan dalam termokimia adalah tentang jumlah kalor yang dapat dihasilkan oleh sejumlah tertentu pereaksi serta cara pengukuran kalor reaksi.
Untuk memahami termokimia perlu dibahas tentang:
- (a) Sistem, lingkungan, dan alam semesta.
- (b) Energi yang dimiliki setiap zat.
- (c) Hukum kekekalan energi
Baca Juga : 60+ Soal Termokimia Pilihan Ganda dan Jawaban [+Pembahasan]
2. Entalpi (H) dan Perubahan Entalpi (∆H)
Sebelum membahas lebih dalam tentang entalpi dan perubahan entalpi, siswa harus memahami terlebih dahulu tentang sistem dan lingkungan, serta macam – macam sistem dan lingkungan.
A. Sistem dan Lingkungan
Jika sepotong pita magnesium kita masukkan ke dalam larutan asam klorida, maka pita magnesium akan segera larut atau bereaksi dengan HCl disertai pelepasan kalor yang menyebabkan gelas kimia beserta isinya menjadi panas.
Campuran pita magnesium dan larutan HCl itu kita sebut sebagai Sistem. Sedangkan gelas kimia serta udara sekitarnya kita sebut sebagai Lingkungan. Jadi, sistem adalah bagian dari alam semesta yang sedang menjadi pusat perhatian. Bagian lain dari alam semesta yang berinteraksi dengan sistem kita sebut lingkungan.
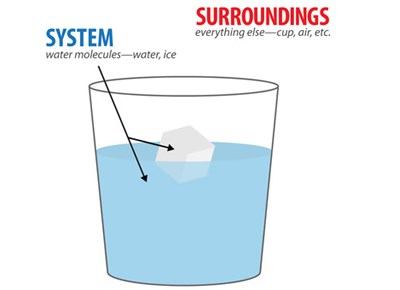
Pada umumnya sebuah sistem jauh lebih kecil dari lingkungannya. Di alam ini terjadi banyak kejadian atau perubahan sehingga alam mengandung sistem dalam jumlah tak hingga, ada yang berukuran besar (seperti tata surya), berukuran kecil (seorang manusia dan sebuah mesin), dan berukuran kecil sekali (seperti sebuah sel dan satu atom).
Akibatnya, satu sistem kecil dapat berada dalam sistem besar, atau satu sistem merupakan lingkungan bagi sistem yang lain. Akan tetapi bila sebuah sistem dijumlahkan dengan lingkungannya, akan sama besarnya dengan sebuah sistem lain dijumlahkan dengan lingkungannya, yang disebut alam semesta. Alam semesta adalah sistem ditambah lingkungannya.
Baca Juga : 60+ Soal Termokimia Pilihan Ganda dan Jawaban [+Pembahasan]
Macam-Macam Sistem
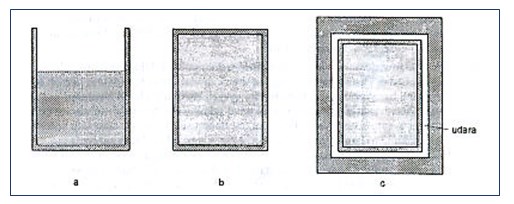
Berdasarkan pertukaran kalor, kerja dan materi, maka sistem dibedakan menjadi tiga yaitu:
- sistem terbuka.
- sistem tertutup.
- sistem terisolasi.
Sistem dikatakan terbuka jika antara sistem dan lingkungan dapat mengalami pertukaran materi dan energi. Pertukaran materi artinya ada hasil reaksi yang dapat meninggalkan sistem (wadah reaksi), misalnya gas, atau ada sesuatu dari lingkungan yang dapat memasuki sistem.
Selanjutnya sistem dikatakan tertutup jika antara sistem dan lingkungan tidak dapat terjadi pertukaran materi, tetapi dapat terjadi pertukaran energi. Pada sistem terisolasi, tidak terjadi pertukaran materi maupun energi dengan lingkungannnya

Secara skema digambarkan sebagai berikut:
Pertukaran energi antara sistem dan lingkungan dapat berupa kalor (q) atau bentuk-bentuk energi lainnya yang secara kolektif kita sebut kerja (w). Adanya pertukaran energi tersebut akan mengubah jumlah energi yang terkandung dalam sistem. Kerja adalah suatu bentuk pertukaran energi antara sistem dan lingkungan di luar kalor.
B. Hukum Kekekalan Energi
Hukum I termodinamika menyatakan hubungan antara energi sistem dengan lingkungannya jika terjadi peristiwa. Energi dalam sistem akan berubah jika sistem menyerap atau membebaskan kalor. Jika sistem menyerap energi kalor, berarti lingkungan kehilangan kalor, energi dalamnya dan sebaliknya, jika lingkungan menyerap kalor atau sistem membebasakan kalor maka energi dalam sistem akan bertambah (DU > 0), berkurang (DU < 0), dengan kata lain sistem kehilangan kalor dengan jumlah yang sama.
Energi dalam juga akan berubah jika sistem melakukan atau menerima kerja. Walaupun sistem tidak menyerap atau membebaskan kalor, energi dalam sistem akan berkurang jika sistem melakukan kerja, sebaliknya akan bertambah jika sistem menerima kerja. Sebuah pompa bila dipanaskan akan menyebabkan suhu gas dalam pompa naik dan volumenya bertambah.
Berarti energi dalam gas bertambah dan sistem melakukan kerja. Dengan kata lain, kalor(q) yang diberikan kepada sistem sebagian disimpan sebagai energi dalam (DU) dan sebagian lagi diubah menjadi kerja (w). Secara matematis hubungan antara energi dalam, kalor dan kerja dalam hukum I termodinamika dapat dinyatakan sebagai berikut:
DU = q + W
Persamaan menyatakan bahwa perubahan energi dalam (DU) sama dengan jumlah kalor yang diserap (q) ditambah dengan jumlah kerja yang diterima sistem (w).
Rumusan hukum I termodinamika dapat dinyatakan :
“Energi tidak dapat diciptakan atau dimusnahkan, tetapi dapat diubah dari satu bentuk ke bentuk yang lain, atau energi alam semesta adalah konstan.“
Karena itu hukum ini disebut juga hukum kekekalan energi . Berdasarkan hukum I termodinamika, kalor yang menyertai suatu reaksi hanyalah merupakan perubahan bentuk energi. Energi listrik dapat diubah menjadi bentuk energi kalor. Energi kimia dapat diubah menjadi energi listrik dan energi listrik dapat diubah menjadi energi kimia. Agar tidak terjadi kekeliruan dalam menggunakan rumus diatas, perlu ditetapkan suatu perjanjian. Maka perjanjian itu adalah:
- Yang diutamakan dalam ilmu kimia adalah sistem, bukan lingkungan
- Kalor (q) yang masuk sistem bertanda positif (+),sedangkan yang keluar bertanda negatif (-)
- Kerja (w) yang dilakukan sistem (ekspansi) bertanda negatif (-) , dan yang dilakukan lingkungan (kompresi) bertanda positif (+),
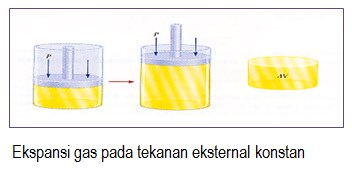
Tanda untuk q dan w dapat dilihat pada Gambar :
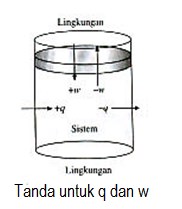
Yang diutamakan dalam ilmu kimia adalah sistem, bukan lingkungan.
Kerja dihitung dengan rumus:
W = – P (V1- V2)
Dimana w = kerja (pada tekanan 1 atm),
V1 = volume awal, dan V2 = volume akhir, dan P = tekanan yang melawan gerakan piston pompa (atm), P untuk ekspansi adalah P ex dan untuk kompresi adalah P in . Penerapan hukum termodinamika pertama dalam bidang kimia merupakan bahan kajian dari termokimia.
Contoh Soal
Suatu sistem menyerap kalor sebanyak 1000 kJ dan melakukan kerja sebanyak 5 kJ. Berapakah perubahan energi dalam sistem ini?
Jawab:
Karena sistem menyerap kalor, maka q bertanda positif, tetapi karena sistem melakukan kerja, maka w bertanda negatif.
DU = q + w
= 100 kJ – 5 kJ
= 95 kJ
3. Reaksi Eksoterm dan Reaksi Endoterm
Perubahan entalpi (∆H) positif menunjukkan bahwa dalam perubahan terdapat penyerapan kalor atau pelepasan kalor. Reaksi kimia yang melepaskan atau mengeluarkan kalor disebut reaksi eksoterm, sedangkan reaksi kimia yang menyerap kalor disebut reaksi endoterm.
A. Persamaan Termokimia
Persamaan reaksi yang mengikutsertakan perubahan entalpinya disebut persamaan termokimia. Nilai ∆H yang dituliskan pada persamaan termokimia disesuaikan dengan stokiometri reaksi. Artinya jumlah mol zat yang terlibat dalam reaksi sama dengan koefisien reaksinya. Oleh karena entalpi reaksi juga bergantung pada wujud zat harus dinyatakan, yaitu dengan membubuhkan indeks s untuk zat padat , l untuk zat cair, dan g untuk zat gas. Perhatikan contoh berikut .
Contoh:
Pada pembentukan 1a mol air dari gas hidrogen dengan gas oksigen dibebaskan 286 kJ. Kata “dibebaskan“ menyatakan bahwa reaksi tergolong eksoterm. Oleh karena itu DH = -286 kJ Untuk setiap mol air yang terbentuk. Persamaan termokimianya adalah:
H2 (g) + 1/2 O2 (g) → H2O (l) DH = -286 kJ
Atau
2H2 (g) + O2 (g) → 2H2O (l) DH = -572 kJ
(karena koefisien reaksi dikali dua, maka harga DH juga harus dikali dua).
B. Diagram Tingkat Energi
Pada reaksi endoterm, sistem menyerap energi. Oleh karena itu, entalpi sistem akan bertambah. Artinya entalpi produk (Hp) lebih besar daripada entalpi pereaksi (Hr). Akibatnya, perubahan entalpi, merupakan selisih antara entalpi produk dengan entalpi pereaksi (Hp – Hr) bertanda positif. Sehingga perubahan entalpi untuk reaksi endoterm dapat dinyatakan:
∆H = Hp – Hr > 0
Sebaliknya, pada reaksi eksoterm , sistem membebaskan energi, sehingga entalpi sistem akan berkurang, artinya entalpi produk lebih kecil daripada entalpi pereaksi. Oleh karena itu , perubahan entalpinya bertanda negatif. Sehingga p dapat dinyatakan sebagai berikut:
∆H = Hp – Hr < 0
Perubahan entalpi pada reaksi eksoterm dan endoterm dapat dinyatakan dengan diagram tingkat energi.

4. Perubahan Entalpi Standar (∆Ho)
Harga perubahan entalpi reaksi dapat dipengaruhi oleh kondisi yakni suhu dan tekanan saat pengukuran. Oleh karena itu, perlu kondisi suhu dan tekanan perlu dicantumkan untuk setiap data termokimia. Data termokimia pada umumnya ditetapkan pada suhu 250C dan tekanan 1 atm yang selanjutnya disebut kondisi standar.
Perubahan entalpi yang diukur pada suhu 250C dan tekanan 1 atm . Disebut perubahan entalpi standar dan dinyatakan dengan lambang ∆Ho Sedangkan perubahan entalpi yang pengukurannya tidak merujuk kondisi pengukurannya dinyatakan dengan lambang ∆H saja. Entalpi molar adalah perubahan entalpi reaksi yang dikaitkan dengan kuantitas zat yang terlibat dalam reaksi. Dalam termokimia dikenal berbagai macam entalpi molar, seperti entalpi pembentukan, entalpi penguraian, dan entalpi pembakaran.
A. Entalpi pembentukan (∆Hof )
Perubahan entalpi pada pembentukan 1 mol zat langsung dari unsur-unsurnya disebut entalpi molar pembentukan atau entalpi pembentukan. Jika pengukuran dilakukan pada keadaan standar (298 k, 1 atm) dan semua unsur-unsurnya dalam bentuk standar, maka perubahan entalpinya disebut entalpi pembentukan standar (∆Hof )Entalpi pembentukan dinyatakan dalam kJ per mol (kJ mol -1) Supaya terdapat keseragaman, maka harus ditetapkan keadaan standar, yaitu suhu 250C dan tekanan 1 atm. Dengan demikian perhitungan termokimia didasarkan pada keadaan standar.
Pada umumnya dalam persamaan termokimia dinyatakan :
AB + CD → AC + BD ∆Ho= x kJ/mol
∆Ho adalah lambang dari perubahan entalpi pada keadaan itu. Yang dimaksud dengan bentuk standar dari suatu unsur adalah bentuk yang paling stabil dari unsur itu pada kondisi standar (298 K, 1 atm). Untuk unsur yang mempunyai bentuk alotropi, bentuk
standarnya ditetapkan berdasarkan pengertian tersebut. Misalnya, karbon yang dapat berbentuk intan dan grafit, bentuk standarnya adalah grafit, karena grafit adalah bentuk karbon yang paling stabil pada 298 K, 1 atm. Dua hal yang perlu diperhatikan berkaitan dengan entalpi pembentukan yaitu bahwa zat yang dibentuk adalah 1 mol
dan dibentuk dari unsurnya dalam bentuk standar.
Contoh soal
Entalpi pembentukan etanol (C2H5OH) (l) adalah -277,7 kJ per mol. Hal ini berarti:
Pada pembentukan 1 mol (46 gram) etanol dari unsur-unsurnya dalam bentuk standar, yaitu karbon (grafit), gas hidrogen dan gas oksigen, yang diukur pada 298 K, 1 atm dibebaskan 277,7 kJ dengan persamaan termokimianya adalah:

Nilai entalpi pembentukan berbagai zat & Persamaan termokimia reaksi pembentukannya.
Pada umumnya entalpi pembentukan senyawa bertanda negatif. Entalpi pembentukan unsur dalam bentuk standarnnya, misalnya entalpi pembentukan grafit, adalah nol.
Perhatikanlah dengan baik hubungan antara nilai entalpi pembentukan dengan persamaan termokimia reaksi pembentukannya, sehingga jika anda mengetahui nilai entalpi pembentukan suatu zat, Anda dapat menuliskan persamaan termokimia yang sesuai.
B. Entalpi Penguraian
Reaksi penguraian adalah kebalikan dari reaksi pembentukan. Oleh karena itu, sesuai dengan azas kekekalan energi, nilai entalpi penguraian sama dengan entalpi pembentukannya, tetapi tandanya berlawanan.
Contoh Soal
Diketahui ∆Hof H2O (l) = -286 kJ mol -1, maka entalpi penguraian
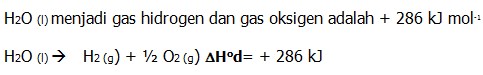
C. Entalpi Pembakaran
Reaksi suatu zat dengan oksigen disebut reaksi pembakaran. Zat yang mudah terbakar adalah unsur karbon, hidrogen, belerang, dan berbagai senyawa dari unsur tersebut. Pembakaran dikatakan sempurna apabila karbon (c) terbakar menjadi CO2, hidrogen (H) terbakar menjadi H2O, belerang (S) terbakar menjadi SO2.
Perubahan entalpi pada pembakaran sempurna 1 mol suatu zat yang diukur pada 298 K, 1 atm disebut entalpi pembakaran standar (standard enthalpy of combustion), yang dinyatakan dengan ∆Hoc Entalpi pembakaran juga dinyatakan dalam kJ mol -1 . Harga entalpi pembakaran dari berbagai zat pada 298 K, 1 atm Harga entalpi pembakaran dari berbagai zat pada 298 K, 1 atm diberikan pada tabel berikut.
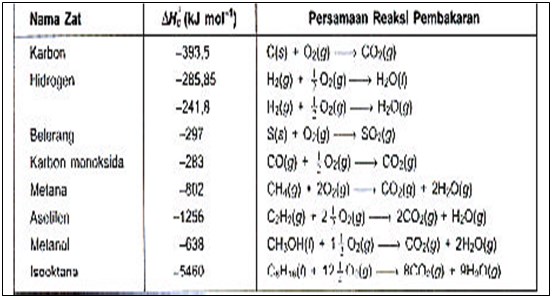
Entalpi Pembakaran dari berbagai zat pada 298 K, 1 atm
Contoh Soal
Pembakaran bensin adalah suatu proses eksoterm. Apabila bensin dianggap terdiri atas isooktana, C8H18 (salah satu komponen bensin) tentukanlah jumlah kalor yang dibebaskan pada pembakaran 1 liter bensin. Diketahui entalpi pembakaran isooktana = -5460 kJ mol-1 dan massa jenis isooktan = 0,7 kg L -1 (H = 1; C =12)
Jawab :
Entalpi pembakaran isooktana yaitu – 5460 kJ mol-1 .
Massa 1 liter bensin = 1 liter x 0,7 kg L-1 = 0,7 kg = 700 gram.
Mol isooktana =700 gram/114 gram mol-1 = 6,14 mol.
Jadi kalor yang dibebaskan pada pembakaran 1 liter bensin adalah: 6,14 mol x 5460 kJ mol -1 =33524,4 kJ.
D. Perubahan Entalpi Reaksi
Setiap sistem atau zat mempunyai energi yang tersimpan didalamnya. Energi potensial berkaitan dengan wujud zat, volume, dan tekanan. Energi kinetik ditimbulkan karena atom – atom dan molekul – molekul dalam zat bergerak secara acak. Jumlah total dari semua bentuk energi itu disebut entalpi (H) . Entalpi akan tetap konstan selama tidak ada energi yang masuk atau keluar dari zat. Misalnya entalpi untuk air dapat ditulis H20 (l) dan untuk es ditulis H20 (s).
Perhatikan lampu spiritus, jumlah panas atau energi yang dikandung oleh spiritus pada tekanan tetap disebut entalpi spiritus. Entalpi tergolong sifat eksternal, yakni sifat yang bergantung pada jumlah mol zat. Bahan bakar fosil seperti minyak bumi, batubara mempunyai isi panas atau entalpi. Entalpi (H) suatu zat ditentukan oleh jumlah energi dan semua bentuk energi yang dimiliki zat yang jumlahnya tidak dapat diukur. Perubahan kalor atau entalpi yang terjadi selama proses penerimaan atau pelepasan kalor dinyatakan dengan “ perubahan entalpi (∆H) “.
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia



