Sifat Koligatif Larutan dan Sifatnya Menurut Hukum Roult [Materi Lengkap] – Dalam kimia, larutan adalah campuran homogen yang terdiri dari dua atau lebih zat. Zat yang jumlahnya lebih sedikit disebut dengan zat terlarut atau solut, sedangkan zat yang jumlahnya lebih banyak daripada zat-zat lain dalam larutan disebut dengan zat pelarut atau solven. Komposisi zat terlarut dan pelarut dalam larutan dinyatakan dalam konsentrasi larutan, sedangkan proses pencampuran zat terlarut dan pelarut membentuk larutan disebut pelarutan atau solvasi.

Konsentrasi larutan menyatakan secara kuantitatif komposisi zat terlarut dan pelarut di dalam larutan. Konsentrasi umumnya dinyatakan dalam perbandingan jumlah zat terlarut dengan jumlah total zat dalam larutan, atau dalam perbandingan jumlah zat terlarut dengan jumlah pelarut. Contoh beberapa satuan konsentrasi adalah molar, molal, dan bagian per juta (part per million, ppm). Sementara itu, secara kualitatif, komposisi larutan dapat dinyatakan sebagai encer (berkonsentrasi rendah) atau pekat (berkonsentrasi tinggi).
Baca Juga : 45+ Soal Sifat Koligatif Larutan Pilihan Ganda [+Pembahasan]
1. Pengertian Sifat koligatif larutan
Sifat koligatif larutan adalah sifat larutan yang tidak tergantung pada macamnya zat terlarut tetapi semata-mata hanya ditentukan oleh banyaknya zat terlarut (konsentrasi zat terlarut). Hukum Roult merupakan dasar dari sifat koligatif larutan. Keempat sifat itu ialah:
- Penurunan tekanan uap relatif terhadap tekanan uap pelarut murni.
- Peningkatan titik didih
- Penurunan titik beku
- Gejala tekanan osmotik.
Sifat koligatif larutan dapat dibedakan menjadai dua macam, yaitu sifat larutan nonelektrolit dan elektrolit. Hal itu disebabkan zat terlarut dalam larutan elektrolit bertambah jumlahnya karena terurai menjadi ion-ion, sedangkan zat terlarut pada larutan nonelektrolit jumlahnya tetap karena tidak terurai menjadi ion-ion, sesuai dengan hal-hal tersebut maka sifat koligatif larutan nonelektrolit lebih rendah daripada sifat koligatif larutan elektrolit.
Larutan merupakan suatu campuran yang homogen dan dapat berwujud padatan, maupun cairan. Akan tetapi larutan yang paling umum dijumpai adalah larutan cair, dimana suatu zat tertentu dilarutkan dalam pelarut berwujud cairan yang sesuai hingga konsentrasi tertentu.
A. Sifat Koligatif Larutan Non Elektrolit
Sifat koligatif larutan non elektrolit sangat berbeda dengan Sifat koligatif larutan elektrolit, disebabkan larutan non elektolit tidak dapat mengurai menjadi ion – ion nya. Maka Sifat koligatif larutan non elektrolit dapat di hitung dengan menghitung tekanan uap, titik didih, titik beku, dan tekanan osmosis. Menurut hukum sifat koligatif, selisih tekanan uap, titik beku, dan titik didih suatu larutan dengan tekanan uap, titik beku, dan titik didih pelarut murninya, berbanding langsung dengan konsentrasi molal zat terlarut.
Larutan yang bisa memenuhi hukum sifat koligatif ini disebut larutan ideal. Kebanyakan larutan mendekati ideal hanya jika sangat encer. Meskipun sifat koligatif melibatkan larutan, sifat koligatif tidak bergantung pada interaksi antara molekul pelarut dan zat terlarut, tetapi bergatung pada jumlah zat terlarut yang larut pada suatu larutan. Sifat koligatif terdiri dari penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik.
B. Sifat Koligatif Larutan Elektrolit
Larutan elektrolit memperlihatkan sifat koligatif yang lebih besar dari hasil perhitungan dengan persamaan untuk sifat koligatif larutan nonelektrolit di atas. Perbandingan antara sifat koligatif larutan elektrolit yang terlihat dan hasil perhitungan dengan persamaan untuk sifat koligatif larutan non elektrolit, menurut Van’t Hoff besarnya selalu tetap dan diberi simbol i (i = tetapan atau faktor Van’t Hoff ) .
Dengan demikian dapat dituliskan: i = sifat koligatif larutan elektrolit dengan kosentrasi m / sifat koligatif larutan nonelektrolit dengan kosentrasi m
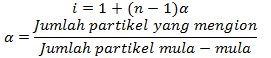
Keterangan:
- n = jumlah seluruh ion zat elektrolit (baik yang + maupun -)
- α = derajat ionisasi larutan elektrolit (untuk elektrolit kuat α = 1)
Banyaknya partikel dalam larutan ditentukan oleh konsentrasi larutan dan sifat larutan itu sendiri. Namun sebelum itu kita harus mengetahui hal- hal berikut:
- Molal, yaitu jumlah mol zat terlarut dalam 1 kg larutan
- Fraksi mol, yaitu perbandingan mol zat terlarut dengan jumlah mol zat pelarut dan zat terlarut.
2. Penurunan Tekanan Uap
Proses penguapan adalah perubahan suatu wujud zat dari cair menjadi gas. Ada kecenderungan bahwa suatu zat cair akan mengalami penguapan. Kecepatan penguapan dari setiap zat cair tidak sama, tetapi pada umumnya cairan akan semakin mudah menguap jika suhunya semakin tinggi
Pengertian
Penurunan tekanan uap adalah kecenderungan molekul-molekul cairan untuk melepaskan diri dari molekul-molekul cairan di sekitarnya dan menjadi uap. Jika ke dalam cairan dimasukkan suatu zat terlarut yang sukar menguap dan membentuk suatu larutan, maka hanya sebagian pelarut saja yang menguap, karene sebagian yang lain penguapannya dihalangi oleh zat terlarut. Besarnya penurunan ini di selidiki oleh Raoult lalu dirumuskan sebagai berikut.
Banyak sedikitnya uap diatas permukaan cairan diukur berdasarkan tekanan uap cairan tersebut. Semakin tinggi suhu cairan semakin banyak uap yang berada diatas permukaan cairan dan berarti tekanan uapnya semakin tinggi. Jumlah uap diatas permukaan akan mencapai suatu kejenuhan pada tekanan tertentu, sebab bila tekanan uap sudah jenuh akan terjadi pengembunan, tekanan uap ini disebut tekanan uap jenuh.
Pada saat zat konvalatil ditambahkan kedalam larutan maka akan terjadi penurunan tekanan uap. Pada suhu 20 C tekanan uap air jenuh diatas permukaan air adalah 17,53 mmHg. Besarnya penurunan tekanan uap air akibat adanya zat terlarut disebut penurunan tekanan uap larutan.
Sejarah Singkat
Sejak tahun 1887 – 1888 Francois Mario Roult telah mempelajari hubungan antara tekanan uap dan konsentrasi zat terlarut, dan mendapatkan suatu kesimpulan bahwa besarnya tekanan uap larutan sebanding dengan fraksi mol pelarut dan tekanan uap dari pelarut murninya. Penurunan tekanan uap menurut hukum Roult, tekanan uap salah satu cairan dalam ruang di atas larutan ideal bergantung pada fraksi mol cairan tersebut dalam larutan. Dari hukum Roult ternyata tekanan uap pelarut murni lebih besar daripada tekanan uap pelarut dalam larutan. Jadi penurunan tekanan uap pelarut berbanding lurus dengan fraksi mol zat terlarut.

Terjadinya penurunan tekanan uap larutan disebabkan oleh adanya zat terlarut. Untuk menentukan seberapa besar pengaruh jumlah partikel zat terlarut terhadap penurunan tekanan uap dapat dituliskan :

Jadi, perubahan tekanan uap pelarut berbanding lurus dengan fraksi mol zat terlarut. Tanda negatif menyiratkan penurunan tekanan uap. Tekanan uap selalu lebih rendah diatas larutan encer dibandingkan diatas pelarut murninya.
3. Peningkatan Titik Didih
Sifat yang berikutnya adalah kenaikan titik didih dan penurunan titik beku. Titik didih larutan selalu lebih tinggi dibandingkan titik didih pelarut. hal sebaliknya berlaku pada titik beku larutan yang lebih rendah dibandingkan pelarut. Sifat ini dirumuskan sebagai berikut :
Konsep Sifatnya
Bila suatu zat cair dinaikkan suhunya, maka semakin banyak zat cair yang menguap. Pada suhu tertentu jumlah uap diatas permukaan zat cair akan menimbulkan tekanan uap yang sama dengan tekanan udara luar. Keadaan saat tekanan uap zat cair diatas permukaan zat cair tersebut sama dengan tekanan udara disekitarnya disebut mendidih dan suhu ketika tekanan uap diatas pemukaan cairan sama dengan tekanan uap luar disebut titik didih. Pada saat zat konvalatil ditambahkan kedalam larutan maka akan terjadi kenaikan titik didih dari larutan tersebut.
Titik didih air murni pada tekanan 1 atm adalah 100 C. Hal itu berarti tekanan uap air murni akan mencapai 1 atm ( sama dengan tekanan udara luar) pada saat air dipanaskan sampai 100 C. Dengan demikian bila tekanan udara luar kurang dari 1 atm (misalnya dipuncak gunung) maka titik didih air kurang dari 100 C.
Bila kedalam air murni dilarutkan suatu zat yang sukar menguap, maka pada suhu 100 C tekanan uap air belum mencapai 1 atm dan berarti air itu belum mendidih. Untuk dapat mendidih ( tekanan uap air mencapai 1 atm) maka diperlukan suhu yang lebih tinggi. Besarnya kenaikan suhu itulah yang disebut kenaikan titik didih.
Menurut hukum Roult
besarnya kenaikan titik didih larutan sebanding dengan hasil kali molalitas larutan (m) dan kenaikan titik didih molalnya (Kb). Dapat dirumuskan sebagai:

Harga Kb bervariasi untuk masing-masing pelarut. Kb diperoleh dengan mengukur kenaikan titik didih dari larutan encer yang molalitasnya diketahui (artinya, mengandung zat terlarut yang diketahui jumlah dan massa molalnya). Titik didih larutan merupakan titik didih pelarut murni ditambah dengan kenaikan titik didihnya atau Tb = Tb + Tb.
Tabel Tetapan Kenaikan Titik Didih (Kb) Beberapa Pelarut
| Pelarut | Titik Didih | Tetapan (Kb) |
| Aseton | 56,2 | 1,71 |
| Benzena | 80,1 | 02,53 |
| Kamfer | 204,0 | 05,61 |
| Karbon Tetraklorida | 76,5 | 04,95 |
| Sikloheksana | 80,7 | 02,79 |
| Naftalena | 217,7 | 05,80 |
| Fenol | 182 | 03,04 |
| Air | 100,0 | 00,52 |
4. Penurunan titik Beku
Proses pembekuan suatu zat cair terjadi bila suhu diturunkan sehingga jarak antar partikel sedemikian dekat satu sama lain dan akhirnya bekerja gaya tarik menarik antar molekul yang sangat kuat. Adanya partikel-partikel dari zat terlarut akan menghasilkan proses pergerakan molekul-molekul pelarut terhalang, akibatnya untuk mendekatkan jarak antar molekul diperlukan suhu yang lebih rendah. Perbedaan suhu adanya partikel-partikel zat terlarut disebut penurunan titik beku. Pada saat zat konvalatil ditambahkan kedalam larutan maka akan terjadi penurunan titik beku larutan tersebut.
Seperti halnya kenaikan titik didih, penurunan titik beku larutan sebanding dengan hasil kali molalitas larutan dengan tetapan penurunan titik beku pelarut (Kf) dinyatakan dengan persamaan:

Titik beku larutan merupakan titik beku pelarut murni dikurangi dengan penurunan titik bekunya. Pengukuran penurunan titik beku, seperti halnya peningkatan titik didih, dapat digunakan untuk menentukan massa molar zat yang tidak diketahui.
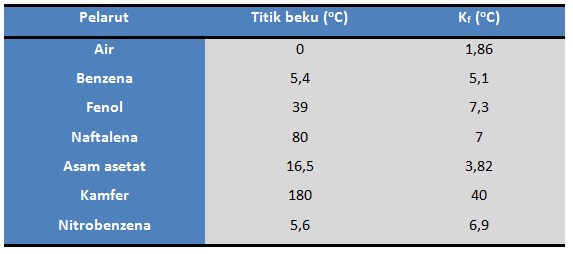
Tabel tetapan titik beku molal (Kf)
5. Tekanan Osmotik
Sifat koligatif keempat terutama penting dalam biologi sel, sebab peranannya penting dalam trasfor molekul melalui membran sel. Membran ini disebut semipermiabel, yang membiarkan molekul kecil lewat tetapi menahan molekul besar seperti protein dan karbohidrat. Membran semi permiabel dapat memisahkan molekul pelarut kecil dari molekul zat terlarut yang besar.
Peristiwa bergeraknya partikel (molekul atau ion) melalui dinding semipermeabel disebut osmotik. Tekanan yang ditimbulkan akibat dari tekanan osmotik disebut tekanan osmotik. Besar tekanan osmotik diukur dengan alat osmometer, dengan memberikan beban pada kenaikan permukaan larutan menjadi sejajar pada permukaan sebelumnya.
Osmosis atau tekanan osmotik adalah proses berpindahnya zat cair dari larutan hipotonis ke larutan hipertonis melalui membran semipermiabel. Osmosis dapat dihentikan jika diberi tekanan, tekanan yang diberikan inilah yang disebut tekanan osmotik. Tekanan osmotik dirumuskan :

Untuk larutan elektrolit ditemukan penyimpangan oleh Vanit Hoff. Penyimpangan ini terjadi karena larutan elektrolit terdisosiasi di dalam air menjadi ion, sehingga zat terlarut jumlahnya menjadi berlipat. Dari sini dibutuhkan faktor pengali atau lumrah disebut faktor Vanit Hoff. Dirumuskan sebagai berikut :

Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia



