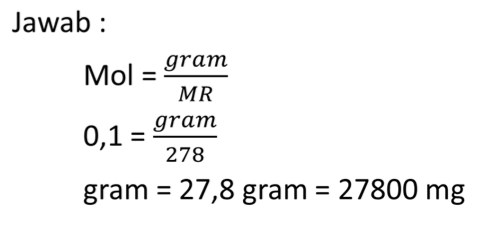10+ Soal Oksidimetri (Kimia Analisis) dan Pembahasan – Oksidimetri merupakan salah satu jenis reaksi kimia yang digunakan analisis volumentrik adalah reaksi oksidasi reduksi. Jenis reaksi ini melibatkan adanya transfer electron antara oksidator dengan reduktor.
Istilah oksidasi mengacu pada setiap perubahan kimia dimana terjadi kenaikan biloks, sedangkan reduksi digunakan untuk setiap penurunan biloks. Oksidator adalah senyawa dimana atom yang terkandung mengalami penurunan biloks. Sebaliknya pada reduktor, atom yang terkandung mengalami kenaikan biloks. Banyak titrasi redoks dilakukan dengan mengunakan indikator warna.
Dalam banyak prosedur analitik, analit ada dalam lebih dari satu keadaan oksidasi dan harus dirubah menjadi keadaan oksidasi tunggal sebelum dilakukan titrasi. Pereaksi redoks yang digunakan harus mampu untuk mengubah analit secara lengkap dan cepat kedalam oksidasi yang diinginkan.
1 – 10 Soal dan Pembahasan Oksidimetri
1. Pada suatu penetapan kadar ferro sulfat (MR = 278) menggunakan metode permanganometri didapatkan hasil volume kalium permanganat 0,1 N yang dibutuhkan untuk mencapai TAT adalah 10 ml. Berapa gram ferro sulfat yang habis dalam reaksi tersebut jika diketahui kesetaraan sbb :
1 ml kalium permanganat 0,1 N setara dengan 27,80 mg ferro sulfat
Jawaban :
1 ml KMnO4 0,1 N ∞ 27,80 mg FeSO4
10 ml KMnO4 0,1 N ∞ X mg FeSO4
x = 10 x 27,80 mg
= 278 mg
2. Berapa miligram FeSO4 (MR = 278) yang harus ditimbang jika diinginkan mol FeSO4 adalah 0,1 mol?
Jawaban :
3. Hitunglah normalitas asam sitrat (20 ml) yang ditetapkan menggunakan metode titrasi asidi-alkalimetri jika diketahui volume HCL 0,1 N yang digunakan untuk titrasi adalah 5 ml!
Jawaban :
Baca Juga : Ebook Kimia Analitik [Buku Analitik Dasar I] untuk Universitas
4. Dalam penetapan kadar vitamin C menggunakan iodimetri, diketahui bahwa jumlah sampel yang bereaksi adalah 0,02 Molar. Jika massa vitamin C yang digunakan adalah 141 mg dan MR vitamin C adalah 176,17 , hitunglah volume vitamin C yang digunakan !
Jawaban :
5. Suatu larutan infus mengandung NaCl sebanyak 0,85 % b/v. Jika untuk penetapan kadar NaCl digunakan 10 ml larutan tsb, berapa miligram NaCl yang terkandung secara teoritis dalam larutan sampel tersebut?
Jawaban :
Baca Juga : Kimia Analisis – Sejarah, Metode Kualitatif dan Kuantitatif dan Aplikasinya
6. 20 tablet sulfametoksazol ditimbang seksama kemudian diserbuk. Diketahui berat total hasil timbangan adalah 12 gram. Sebanyak 0,3 gram serbuk tsb digunakan untuk penetapan kadar menggunakan titrasi nitrimetri dengan prosedur sebagai berikut :
0,3 gram serbuk ditambah 5 ml HCl encer dan 50 ml air. Didinginkan hingga suhu 15°C kemudian dititrasi dengan natrium nitrit 0,05M hingga 1 tetes larutan segera memberikan warna biru pada kertas kanji iodida. Untuk itu diperlukan 15 ml natrium nitrit 0,05 M.
Jika diketahui kandungan sulfametoksazol per tablet adalah 400 mg, tentukan kadar sulfametoksazole tersebut! (valensi 2, MR sulfametoksazol = 253,28)
Jawaban :
7. Dalam suatu praktikum spektrofotometri, ingin dibuat larutan baku induk asam salisilat dengan konsentrasi 500 ppm. Jika volume yang diinginkan adalah 1000 ml, tentukan berapa gram asam salisilat yang harus ditimbang?
Jawaban :
8. Dari soal di atas, jika ingin dibuat pengenceran baku induk menjadi 20 ppm dalam labu 100 ml, tentukan berapa ml baku induk yg harus dipipet!
Jawaban :
9. Soal iodometri tentukanlah :
a. 10ml injeksi natrium tiosulfat ditambahkan HCL encer hingga pH lebih kurang 7, lalu di encerkan dengan air secukupnya hingga lebih kurang 20ml. Setelah di titrasi menggunakan indikator kanji ternyata memerlukan 40,20ml larutan iod 0,1N.
b. Berapa % b/v Na2S4O3.5H2O dalam injeksi natrium tiosulfat itu 1 ml 0,1 N setara dengan 24,82 mg Na2S4O3.5H2O
Jawaban :
Pembahasan :
a. 2Na2S2O3 + I2 → 2NaI + Na2S4O6
Mg natrium tiosulfat = 40,20 x 24,82mg
= 997,8 mg
= 0,9978 g
b. %b/v Na2S4O3.5H2O = 0,9978/10 x 100
= 9,978%
10. Pada pembuatan Na2SO3 : Larutan iodin 15 ml 0,1 M dimasukkan ke Erlenmeyer, tambahkan beberapa tetes indicator amilum, titrasilah dengan larutan Na2SO3 sampai tidak berwarna (didapatkan V Na2S2O3 = 22 ml). Kemudian 20 ml CuSo4 + 5 ml H2SO4 2 M + 0,5 gram KI, campuran berwarna kuning + larutan kanji / indicator amilum perlahan sampai warna keunguan. Titrasi dengan Na2S2O3 sampai warna ungu tersebut menghilang (didapatkan V Na2S2O3 = 8,5 ml). Tentukanlah kadar CuSo4 ?
Jawaban :
Pembahasan :
- Pembuatan Na2S2O3:
V I2 = 15 ml
M I2 = 0,1 M
V Na2S2O3 = 22 ml
- Penentuan kadar Cu:
V CuSO4 = 20 ml
V H2SO4 = 5 ml
M KI = 0,5 gr
M H2SO4 = 2 M
V larutan kanji = 4 ml (80 tetes)
V Na2S2O3 = 8,5 ml
- Sehingga Standarisasi Na2S2O3 terhadap I2
V1.N1 = V2.N2
15 x 0,1 = 22 x N2
N2 = 1,5/ 22 = 0,07 N
Permanganometri
11. Dalam suasana asam besi (II) dititrasi dengan larutan kalium permanganat 0,0206 M, larutan KMnO4 yang diperlukan 40,20 mL. Hitunglah mg besi dalam larutan tersebut?
Jawaban :
Pembahasan :
Dalam suasan asam:
MnO4- + 8H++ 5e → Mn2+ + 4H2O x 1
Fe2+ → Fe3++ e x 5
MnO4-+ 8H+ + 5Fe2+ → Mn2+ + 4H2O + 5Fe3+
Pada titik ekivalen:
Mol KMnO4 = M.V
Mol KMnO4 = M.V
= 0,0206 M x 40,2 mL
= 0,828 mmol
5 mol Fe ≈ 1 mol KMnO4
mol Fe yang diperlukan = 5 x 0,828 mmol
= 4,14 mmol
Banyaknya Fe yang diperlukan adalah:
= 4,14 mmol Ar.Fe.
= 231,8 mgram
Download File dalam format .doc atau .pdf agar mudah dibaca dan tertata rapi lengkap dengan peta konsep dan prasyarat materi.
Link Download Soal dan Pembahasan Oksidimetri
Sudah selesai membaca dan berlatih soal ini ? Ayo lihat dulu Daftar Soal Kimia lainnya