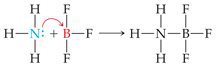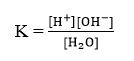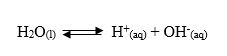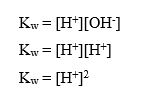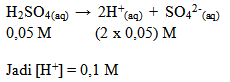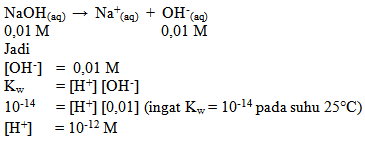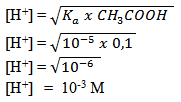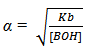Asam Basa – Pengertian, Teori, Derajat Keasaman (PH) dan Reaksinya – Materi yang sangat kompleks dan menjadi dasar saat siswa belajar pada kelas 11 SMA Semester 2. Jadi usahakan jangan sampai kamu tertinggal ataupun tidak paham materi asam basa karena sangat sulit untuk mengerti pada materi berikutnya.
Anda tentu sering mendengar larutan asam sulfat dan asam nitrat bukan? Kedua larutan tersebut dapat digunakan untuk menghilangkan lapisan oksida pada permukaan logam sebelum dilakukan pengecatan. Demikian pula, dengan susu magnesia (natrium bikarbonat) dan larutan amonia yang dapat dimanfaatkan dalam pembuatan fiber kertas.
Menurut Anda, sifat apakah yang terkandung dalam senyawa tersebut? Selama Anda mempelajari kimia Anda tentu juga telah mengetahui tentang larutan yang bersifat asam dan larutan yang bersifat basa. Asam dan basa merupakan salah satu sifat zat (larutan maupun nonpelarut).
Sifat asam dan basa memiliki peran penting dalam proses kimia di alam, makhluk hidup, maupun industri. Apakah sebenarnya sifat asam basa itu? Bagaimanakah menentukan sifat suatu zat berdasarkan asam basa? Bagaimanakah cara menghitung derajat keasaman (pH) suatu larutan? Semua pertanyaan di atas akan Anda temukan jawabannya setelah Anda mempelajarinya.
Baca Juga : 45+ Soal Asam Basa Pilihan Ganda dan Jawaban serta [+Pembahasan]
1. Pengertian Asam Basa
Asam dalam pelajaran kimia adalah senyawa kimia yang bila dilarutkan dalam air akan menghasilkan larutan dengan pH lebih kecil dari 7. Dalam definisi modern, asam adalah suatu zat yang dapat memberi proton (ion H+) kepada zat lain (yang disebut basa), atau dapat menerima pasangan elektron bebas dari suatu basa. Asam adalah zat (senyawa) yang menyebabkan rasa masam pada berbagai materi.
Contoh asam dalam kehidupan sehari – hari :



Ciri – ciri asam :
- Dapat menimbulkan korosif
- Rasanya asam.
- Mengubah kertas lakmus biru menjadi merah
- PH < 7
- Menghasilkan ion H+
Basa adalah senyawa kimia yang menyerap ion hidronium ketika dilarutkan dalam air. Basa memiliki pH lebih besar dari 7. Basa adalah zat (senyawa) yang dapat bereaksi dengan asam, menghasilkan senyawa yang disebut garam.
Contoh basa dalam kehidupan sehari – hari :



Ciri – ciri basa:
- Rasanya pahit
- Terasa licin di kulit
- Mengubah kertas lakmus merah menjadi biru
- PH > 7
- Menghasilkan OH- dalam air
2. Teori Asam Basa
Apakah yang menentukan suatu senyawa bersifat asam atau basa? Definisi asam dan basa pun akhirnya menjadi rumusan masalah bagi para ahli selama ratusan tahun.
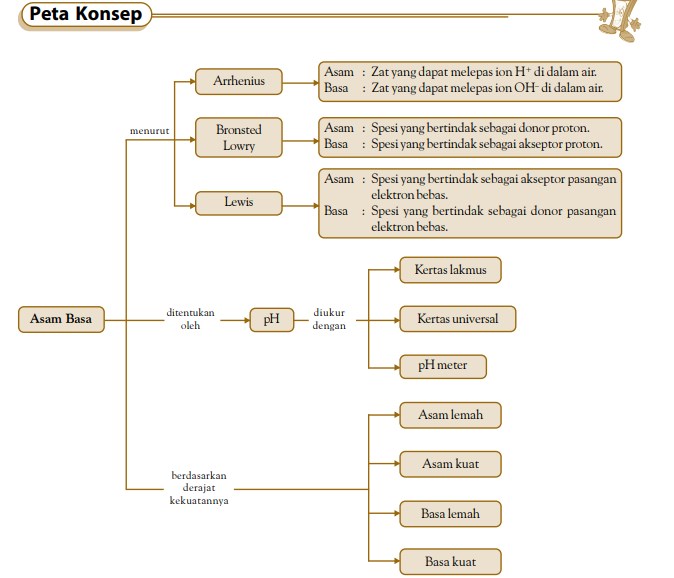
Dari berbagai teori definisi asam basa yang pernah diajukan, terdapat tiga teori yang sangat bermakna, antara lain teori asam basa Arrhenius, teori asam basa Brønsted–Lowry, dan teori asam basa Lewis.
A. Teori Asam Basa Arrhenius
Teori ini pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius. Menurut Arrhenius, definisi dari asam dan basa, yaitu:
Asam adalah senyawa yang jika dilarutkan dalam air melepaskan ion H+.
Basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion OH−.
HCl(aq) → H+(aq) + Cl–(aq)
Gas asam klorida (HCl) yang sangat larut dalam air tergolong asam Arrhenius, sebagaimana HCl dapat terurai menjadi ion H+dan Cl− di dalam air.
Berbeda halnya dengan metana (CH4) yang bukan asam Arrhenius karena tidak dapat menghasilkan ion H+ dalam air meskipun memiliki atom H. Natrium hidroksida (NaOH) termasuk basa Arrhenius, sebagaimana NaOH merupakan senyawa ionik yang terdisosiasi menjadi ion Na+ dan OH− ketika dilarutkan dalam air. Konsep asam dan basa Arrhenius ini terbatas pada kondisi air sebagai pelarut.
B. Teori Asam Basa Brønsted–Lowry
Pada tahun 1923, Johannes N. Brønsted dan Thomas M. Lowry secara terpisah mengajukan definisi asam dan basa yang lebih luas. Konsep yang diajukan tersebut didasarkan pada fakta bahwa reaksi asam–basa melibatkan transfer proton (ion H+) dari satu zat ke zat lainnya. Proses transfer proton ini selalu melibatkan asam sebagai pemberi/donor proton dan basa sebagai penerima/akseptor proton. Jadi, menurut definisi asam basa Brønsted–Lowry :
Asam adalah donor proton.
Basa adalah akseptor proton.
Jika ditinjau dengan teori Brønsted–Lowry, pada reaksi ionisasi HCl ketika dilarutkan dalam air, HCl berperan sebagai asam dan H2O sebagai basa.
HCl(aq) + H2O(l) → Cl−(aq) + H3O+(aq)
HCl berubah menjadi ion Cl− setelah memberikan proton (H+) kepada H2O. H2O menerima proton dengan menggunakan sepasang elektron bebas pada atom O untuk berikatan dengan H+ sehingga terbentuk ion hidronium (H3O+).
C. Teori Asam Basa Lewis
Pada tahun 1923, G. N. Lewis mengemukakan teori asam basa yang lebih luas dibanding kedua teori sebelumnya dengan menekankan pada pasangan elektron yang berkaitan dengan struktur dan ikatan. Menurut definisi asam basa Lewis :
Asam adalah akseptor pasangan elektron.
Basa adalah donor pasangan elektron.
Berdasarkan definisi Lewis, asam yang berperan sebagai spesi penerima pasangan elektron tidak hanya H+. Senyawa yang memiliki orbital kosong pada kulit valensi seperti BF3 juga dapat berperan sebagai asam. Sebagai contoh, reaksi antara BF3 dan NH3 merupakan reaksi asam–basa, di mana BF3 sebagai asam Lewis dan NH3 sebagai basa Lewis. NH3 memberikan pasangan elektron kepada BF3 sehingga membentuk ikatan kovalen koordinasi antara keduanya.
Kelebihan definisi asam basa Lewis adalah dapat menjelaskan reaksi-reaksi asam–basa lain dalam fase padat, gas, dan medium pelarut selain air yang tidak melibatkan transfer proton. Misalnya, reaksi-reaksi antara oksida asam (misalnya CO2 dan SO2) dengan oksida basa (misalnya MgO dan CaO), reaksi-reaksi pembentukan ion kompleks seperti [Fe(CN)6]3−, [Al(H2O)6]3+, dan [Cu(NH3)4]2+, dan sebagian reaksi dalam kimia organik.
3. Derajat Keasaman (pH)
Konsentrasi ion hidronium [H+] dalam suatu larutan encer relatif kecil tetapi sangat menentukan sifat-sifat larutan, terutama larutan dalam air. Sorensen (1868 – 1939) mengusulkan konsep “pH” (pangkat ion hidrogen) agar memudahkan pengukuran dan perhitungan untuk mengikuti perubahan konsentrasi ion H+ dalam suatu larutan. Menurut sorensen, pH merupakan fungsi negatif logaritma dari konsentrasi ion H+ dalam suatu larutan, dan dirumuskan sebagai berikut.
pH = – log [H+]
Dengan analogi yang sama, untuk menentukan nilai konsentrasi OH– dalam larutan dapat digunakan rumus nilai pOH.
pOH = – log [OH–]
Dalam kesetimbangan air terdapat tetapan kesetimbangan :
Kw = [H+] [OH–]
Baca Juga : 45+ Soal Asam Basa Pilihan Ganda dan Jawaban serta [+Pembahasan]
Contoh Soal :
Hitunglah pH air murni pada suhu 25°
jawab :
pH = -log 10-7
= -(-7)
= 7
Oleh karena [H+] dan [OH–] dalam air murni adalah sama, dapat ditentukan pula nilai pOH pada air murni.
pOH = -log [OH–]
= -log 10-7
= 7
atau dengan menggunakan rumus :
pH + pOH = 14
7 + pOH = 14
pOH = 7
A. Nilai pH dan Sifat Larutan
Air murni mempunyai nilai pH = 7 dan pOH = 7. Bagaimana nilai pH larutan yang bersifat asam atau bersifat basa ? Beberapa contoh berikut dapat digunakan untuk menemukan hubungan nilai pH dan pOH dengan kondisi suatu larutan.
Contoh Soal :
Larutan asam kuat HCl 0,1 M
jawab :
HCl(aq) → H+(aq) + Cl–(aq)
0,1 M 0,1 M
[H+] = 0,1 M
pH = -log 0,1
pH = 1
Oleh karena larutan dalam air, nilai pOH dapat ditentukan berdasarkan nilai tetapan kesetimbangan air Kw = 10-14
[H+] [OH–] = 10-14
0,1 [OH–] = 10-14
[OH–] = 10-13 M
pOH = -log 10-13
pOH = 13
Contoh Soal :
Larutan asam lemah CH3COOH 0,1 M Ka = 10-5
jawab :
[H+] = 10-3
pH = -log 10-3
pH = 3
pOH = 14 – pH
pOH = 11
Contoh Soal :
Larutan basa kuat NaOH 0,1 M
NaOH(aq) → Na+(aq) + OH–(aq)
jawab :
0,1 M 0,1 M
[OH–] = 0,1 M
pOH = -log 0,1
pOH = 1
pH + pOH = 14
Contoh Soal :
Basa lemah NH4OH 0,1 M, Kb = 10-5
jawab :
[OH–] = 10-3
pOH = pOH -log 10-3
pOH = 3
pH = 14 – pOH
pH = 11
Nilai pH dapat memberikan informasi tentang kekuatan suatu asam atau basa. Untuk konsentrasi yang sama, semakin kuat suatu asam, semakin besar konsentrasi ion H+ dalam larutan, dan nilai pH-nya semakin kecil. Semakin kuat suatu asam, semakin kecil nilai pH-nya.
Sebaliknya semakin kuat suatu basa, semakin besar konsentrasi ion OH– dalam larutan. Semakin besar konsentrasi ion OH–, semakin kecil konsentrasi ion H+ dalam larutan. Akibatnya, nilai pH menjadi semakin besar. Semakin kuat suatu basa, semakin besar nilai pH-nya.
B. Indikator Asam Basa dan Nilai pH
Untuk mengetahui nilai pH suatu larutan dapat dilakukan dengan menggunakan pH meter atau indikator universal.

pH meter merupakan suatu rangkaian alat elektronik yang dilengkapi dengan elektroda kaca. Jika elektroda kaca ini dimasukan kedalam larutan, akan timbul beda potensial yang diakibatkan oleh adanya ion H+ dalam larutan. Besarnya beda potensial ini ditunjukan dengan angka yang menyatakan pH larutan tersebut.
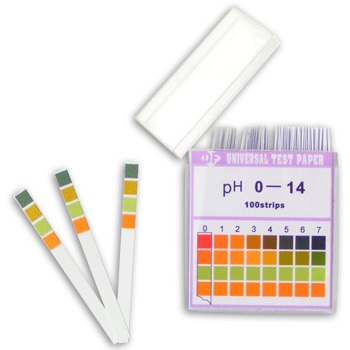
Indikator universal adalah indikator pH berisi larutan dari beberapa senyawa yang menunjukkan beberapa perubahan warna yang halus pada rentang pH antara 1-14 untuk menunjukkan keasaman atau kebasaan larutan.
Selain itu asam basa dapat ditentukan dengan indikator asam basa yang merupakan suatu zat yang mempunyai warna tertentu pada pH tertentu. Sebagai contoh bromtimol biru (BTB) akan berwarna kuning dalam lingkungan asam, berwarna biru dalam basa, dan berwarna hijau pada suasana netral.
Indikator tunggal hanya akan menunjuk hasil secara umum, misalnya suatu larutan ditetesi indikator PP berwarna merah, berarti larutan tersebut mempunyai pH > 8,3. Untuk mendapatkan hasil yang lebih teliti dapat digunakan beberapa indikator terhadap satu larutan.
pH + 1 = 14
pH = 13
4. Kesetimbangan Ion dalam Larutan Asam Basa
Air yang ada di alam, seperti air laut merupakan campuran berbagai macam larutan garam yang dapat memengaruhi pH. Campuran tersebut juga dapat mempertahankan harga pH, walaupun air sungai yang mengalir ke laut bersifat asam atau basa. Mengapa hal tersebut dapat terjadi? Selain itu, ada juga garam-garam yang hampir tidak larut dalam air pada pH tertentu, tetapi dapat larut dalam pH yang berbeda.
A. Kesetimbangan Air
Air merupakan elektrolit yang sangat lemah karena sebagian kecil molekul air terionisasi dengan reaksi:
Ionisasi air ini merupakan reaksi kesetimbangan sehingga berlaku hukum kesetimbangan:
Air murni mempunyai konsentrasi yang tetap sehingga hasil kali dari konsentrasi air murni dengan K akan menghasilkan nilai yang tetap.
Oleh karena nilai K[H2O] tetap, tetapan kesetimbangan air dinyatakan sebagai tetapan ionisasi air dan diberi lambang Kw.
Nilai tetapan ionisasi air tetap pada suhu tetap. reaksi ionisasi air merupakan reaksi endoterm sehingga bila suhunya naik, nilai Kw akan semakin besar. Pada suhu 25oC, nilai Kw adalah 10-14. Persamaan reaksi ionisasi air berikut,
menunjukkan bahwa [H+] = [OH–]
B. Pengaruh Asam dan Basa Terhadap Kesetimbangan Air
Adanya ion H+ yang dihasilkan oleh suatu asam dan ion OH– yang dihasilkan oleh suatu basa dapat mengakibatkan terjadinya pergeseran kesetimbangan pada reaksi kesetimbangan air :
Asam Kuat
Asam kuat merupakan asam yang dianggap terionisasi sempurna dalam larutannya.
Secara umum, apabila di dalam air terdapat asam kuat (HnA) dengan konsentrasi a mol/liter, konsentrasi ion H+ dalam asam tersebut dapat dihitung dengan cara :
dengan a = kemolalan asam
n = jumlah ion H+ yang dihasilkan dari ionisasi asam
Hitunglah Konsentrasi ion H+ dalam larutan H2SO4 0,05 M.
Contoh Soal :
jawab :
Basa Kuat
Basa kuat sama halnya dengan asam kuat, yaitu basa yang didalam larutannya dianggap terionisasi sempurna.
Secara umum jika didalam air terdapat basa kuat (L(OH)n) dengan konsentrasi b mol/liter, konsentrasi ion OH– dalam basa tersebut dapat dihitung dengan cara :
dengan b = kemolalan basa
n = jumlah ion OH– yang dihasilkan dari ionisasi basa
Contoh Soal :
Hitunglah H+ dan OH– yang terdapat dalam larutan NaOH 0,01 M.
jawab :
Asam Lemah
Asam lemah adalah asam yang didalam larutannya hanya sedikit terionsiasi atau mempunyai derajat ionisasi yang kecil. Reaksi ionisasi pada asam lemah merupakan reaksi kesetimbangan ionisasi, misalnya untuk asam HA :
Tetapan ionisasi pada asam lemah diberi lambang Ka :
Setiap satu molekul HA yang terionisasi akan menghasilkan sebuah ion H+ dan sebuah ion A–. Oleh karena itu, konsentrasi ion H+ yang berasal dari HA akan selalu sama dengan konsentrasi ion A– atau [H+] = [A–] sehingga konsentrasi ion A– dapat disubstitusikan ke dalam persamaan :
Oleh karena itu [H+] = [A–], Maka :
atau
dengan Ka = Ketetapan ionisasi asam
[HA] = Konsentrasi asam
Nilai Ka menggambarkan kekuatan asam. Semakin besar nilai Ka berarti semakin banyak ion H+ yang dihasilkan, atau semakin kuat asam tersebut. Selain nilai Ka besaran lain yang dapat digunakan untuk mengetahui asam adalah derajat ionisasi (α).
Rumus tersebut menunjukkan bahwa jika larutan semakin encer, derajat ionisasinya semakin besar. Demikian juga jika larutan semakin pekat, derajat ionisasinya semakin kecil. Asam sangat pekat bahkan mempunyai derajat ionisasi mendekati nol.
Contoh Soal :
Hitunglah konsentrasi ion H+ di dalam larutan CH3COOH 0,01 M jika tetapan ionisasi (Ka) CH3COOH = 10-5
jawab :
Asam Poliprotik
Asam poliprotik adalah asam yang dalam larutannya dapat melepaskan lebih dari satu ion H+ , misalnya, H2CO3 , H3PO4 , dan H2S.
Nilai tetapan kesetimbangan secara keseluruhan merupakan hasil kali dari Ka pada tahapan reaksi-reaksi kesetimbangan secara keseluruhan.
Basa Lemah
Basa Lemah seperti halnya asam lemah, basa lemah hanya sedikit mengalami ionisasi sehingga reaksi ionisasi basa lemah merupakan reaksi kesetimbangan :
Dengan cara penurunan yang sama, didapatkan rumus untuk menghitung konsentrasi OH– dalam larutan adalah sebagai berikut.
dan derajat ionisasinya dapat ditentukan dengan rumus:
Kb dan α dapat digunakan sebagai ukuran kekuatan basa. semakin besar nilai Kb, semakin kuat basanya dan semakin besar nilai derajat ionisasinya.
5. Reaksi Asam dengan Basa
A. Reaksi Netralisasi
Reaksi antara larutan asam dengan larutan basa untuk membentuk larutan yang bersifat netral disebut dengan netralisasi atau penetralan. Secara umum netralisasi merupakan reaksi antara sejumlah ion H+ dengan sejumlah ion OH– yang sama banyaknya sehingga akhirnya membentuk molekul H2O. Reaksi ini dapat disebut sebagai reaksi pembentukan garam atau penggaraman. Persamaan reaksinya dapat dituliskan dalam bentuk persamaan reaksi molekuler dan persamaan reaksi ion.
Reaksi Molekuler
Reaksi Ion
Reaksi ini menunjukkan bahwa setiap molekul didalam larutan mengalami ionisasi.
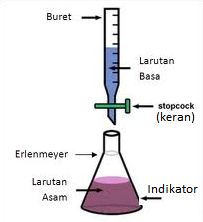
B. Titrasi Asam Basa
Salah satu penerapan reaksi netalisasi adalah titrasi. Titrasi merupakan prosedur yang bertujuan untuk menentukan banyaknya suatu larutan dengan konsentrasi yang telah diketahui agar tepat habis bereaksi dengan sejumlah larutan yang dianalisis (ingin diketahui kadarnya).
Titrasi yang mengacu pada jumlah volume larutan dikenal dengan istilah titrasi volumetrik. Pengukuran volume diusahakan setepat mungkin dengan menggunakan alat-alat standar, misalnya buret, pipet gondok, dan pipet volumetrik. Titrasi yang melibatkan reaksi antara asam dengan basa dikenal dengan istilah titrasi asam basa atau asidi alkalimetri.
Baca Juga : 45+ Soal Asam Basa Pilihan Ganda dan Jawaban serta [+Pembahasan]
Secara teknis, titrasi dilakukan dengan cara mereaksikan sedikit demi sedikit atau tetes demi tetes larutan basa melalui buret kedalam larutan asam dengan volume tertentu yang terletak dalam labu erlenmeyer sampai keduanya tepat habis berekasi ditandai dengan berubahnya warna indikator.
Tepat pada saat warna indikator berubah, penambahan (titrasi) dihentikan dan volumenya dicatat sebagai volume titik ahir titrasi. Larutan basa yang diletakan dalam buret disebut dengan larutan penitrasi. Indikator yang digunakan pada titrasi asam basa adalah indikator yang mempunyai trayek perubahan warna pH sekitar 7, sebab pada saat asam kuat dan basa kuat telah tepat habis bereaksi, pada saat itu pH larutan akan sama dengan 7.
Perubahan warna indikator yang menandai tepat bereaksinya kedua larutan tidak selamanya tepat seperti perhitungan secara teoritis. Volume larutan penitrasi yang diperoleh melalui perhitungan secara teoritis disebut dengan volume titik ekivalen. Perbedaan volume titik akhir titrasi dengan titik ekivalen disebut dengan kesalahan titrasi. Besar kecilnya kesalahan titrasi ditentukan oleh pemilihan indikator. Jika indikatormya semakin tepat, kesalahan titrasinya kecil.
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia