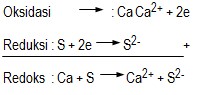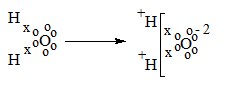Konsep Reaksi Redoks – Contoh, Cara Menentukan Biloks dan Tatanama – Materi dasar redoks dipelajari pada kelas 10 SMA semester 2 dimana akan dilanjutkan juga nantinya pada kelas 12 lebih mendalam tentang penyetaraan reaksi redoks.

Reaksi redoks adalah reaksi yang melibatkan reaksi reduksi dan reaksi oksidasi. Pengertian reaksi oksidasi dan reaksi reduksi berkembang sesuai dengan perkembangan ilmu kimia. Reaksi reduksi dan reaksi oksidasi banyak terjadi dalam kehidupan sehari-hari, misalnya reaksi pembakaran, pembuatan cuka dari alkohol, peristiwa pemecahan glukosa di dalam tubuh, perkaratan besi, dan lain-lainnya.
1. Konsep Reaksi Redoks
Redoks adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia.
Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana (CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh manusia melalui rentetan transfer elektron yang rumit.
Istilah redoks berasal dari dua konsep, yaitu reduksi dan oksidasi. Ia dapat dijelaskan dengan mudah sebagai berikut:
- Oksidasi merupakan pelepasan elektron oleh sebuah molekul, atom, atau ion
- Reduksi merupakan penangkapan elektron oleh sebuah molekul, atom, atau ion.
Contoh:
C(s) + O2(g) → CO2(g)
H2(g) + O2(g) → H2O(l)
2Cu(s) + O2(g) → 2CuO(s)
Reaksi reduksi merupakan reaksi pelepasan oksigen oleh suatu zat.
Contoh:
HgO(s) → Hg(l) + O2(g)
FeO(s) + CO(g) → Fe(s) + CO2(g)
Tinjauan reaksi reduksi dan oksidasi berdasarkan pengikatan dan pelepasan oksigen ternyata kurang universal (luas) karena reaksi kimia tidak hanya melibatkan oksigen saja. Misalnya, reaksi kimia antara gas klorin dan logam natrium membentuk natrium klorida.
Na(s) + ½Cl2(g) → NaCl(s)
Konsep reaksi reduksi dan oksidasi selanjutnya dijelaskan dengan menggunakan konsep perpindahan (transfer) elektron. Oksidasi adalah reaksi pelepasan elektron, sedangkan reduksi adalah reaksi pengikatan elektron. Dengan menggunakan konsep tersebut, maka dapat dijelaskan terjadinya reaksi oksidasi dan reaksi reduksi pada reaksi antara gas klorin dengan logam natrium sebagai berikut.
Na(s) + ½ Cl2(g) → NaCl(s)
Dalam reaksi itu terdapat 2 peristiwa, yaitu:
Na(s) → NA+(s) + e- ……… (oksidasi)
½ Cl2 + e- → Cl- ……… (reduksi)
Berdasrkan konsep tersebut dapat dinyatakan bahwa peristiwa reaksi oksidasi reduksi terjadi secara bersamaan.
Reaksi transfer elektron terjadi pada senyawa-senyawa yang berikatan ion. Ion positif terbentuk karena suatu atom melepas elektronnya, sedangkan ion negatif terbentuk karena suatu atom mengikat elektron.
Oleh karena itu, konsep reaksi redoks yang didasarkan pada perpindahan (transfer) elektron cukup memuaskan untuk menjelaskan reaksi-reaksi pembentukkan senyawa ion.
Baca Juga : 45+ Soal Penyetaraan Reaksi Redoks Pilihan Ganda [+Pembahasan]
2. Perkembangan Konsep Redoks
Konsep reaksi redoks akan terus berkembang seiring juga dengan perkembangan ilmu kimia.
Reaksi redoks sebagai reaksi pengikatan dan pelepasan oksigen
1). Oksidasi adalah : reaksi pengikatan oksigen.
Contoh :
- Perkaratan besi (Fe).
4Fe(s) + 3O2(g) → 2Fe2O3(s)
- Pembakaran gas metana
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
- Oksidasi tembaga oleh udara
2Cu(s) + 3O2(g) → 2CuO(s)
- Oksidasi glukosa dalam tubuh
C6H12O6(aq) + 6O2(g) → 6CO2(g) + 6H2O(l)
- Oksidasi belerang oleh KClO3
3S(s) + 2KClO3(s) → 2KCl(s) + 3SO2(g)
- Sumber oksigen pada reaksi oksidasi disebut oksidator. Dari contoh di atas, 4 reaksi menggunakan oksidator berupa udara dan reaksi terakhir menggunakan oksidator berupa KClO3
2). Reduksi adalah : reaksi pelepasan atau pengurangan oksigen.
Contoh :
- Reduksi bijih besi dengan CO
Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g)
- Reduksi CuO oleh H2
CuO(s) + H2(g) → Cu(s) + H2O(g)
- Reduksi gas NO2 oleh logam Na
2NO2(g) + Na(s) → N2(g) + Na2O(s)
- Zat yang menarik oksigen pada reaksi reduksi disebut reduktor. Dari contoh di atas, yang bertindak sebagai reduktor adalah gas CO, H2 dan logam Na.
Reaksi redoks sebagai reaksi pelepasan dan pengikatan / penerimaan elektron
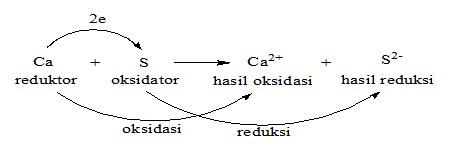
1). Oksidasi adalah : reaksi pelepasan elektron.
- Zat yang melepas elektron disebut reduktor (mengalami oksidasi).
- Pelepasan dan penangkapan elektron terjadi secara simultan artinya jika ada suatu spesi yang melepas elektron berarti ada spesi lain yang menerima elektron. Hal ini berarti : bahwa setiap oksidasi disertai reduksi.
- Reaksi yang melibatkan oksidasi reduksi, disebut reaksi redoks, sedangkan reaksi reduksi saja atau oksidasi saja disebut setengah reaksi.
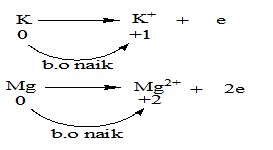
Contoh : (setengah reaksi oksidasi)
K → K+ + e
Mg → Mg2+ + 2e
2). Reduksi adalah : reaksi pengikatan atau penerimaan elektron.
- Zat yang mengikat/menerima elektron disebut oksidator (mengalami reduksi).
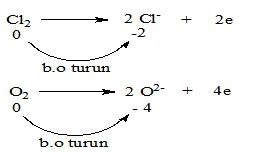
Contoh : (setengah reaksi reduksi)
Cl2 + 2e → 2Cl–
O2 + 4e → 2O2–
Contoh : reaksi redoks (gabungan oksidasi dan reduksi)
Keterangan :
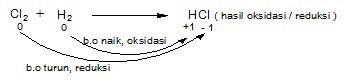
Reaksi redoks sebagai reaksi peningkatan dan penurunan bilangan oksidasi
1). Oksidasi adalah : reaksi dengan peningkatan bilangan oksidasi (b.o).
Zat yang mengalami kenaikan bilangan oksidasi disebut reduktor.
Contoh :
2). Reduksi adalah : reaksi dengan penurunan bilangan oksidasi (b.o).
Zat yang mengalami penurunan bilangan oksidasi disebut oksidator.
Contoh :
3. Konsep Bilangan Oksidasi
Bilangan oksidasi suatu unsur dalam suatu senyawa adalah muatan yang diemban oleh atom unsur itu jika semua elektron ikatan didistribusikan kepada unsur yang lebih elektronegatif.
Contoh :
Pada NaCl :
atom Na melepaskan 1 elektron kepada atom Cl, sehingga b.o Na = +1 dan Cl = -1.
Pada H2O :
Karena atom O lebih elektronegatif daripada atom H maka elektron ikatan didistribusikan kepada atom O.
Jadi b.o O = -2 sedangkan H masing-masing = +1.
Aturan Menentukan Bilangan Oksidasi
1). Semua unsur bebas mempunyai bilangan oksidasi = 0 (nol).
Contoh : bilangan oksidasi H, N dan Fe dalam H2, N2 dan Fe = 0.
2). Fluorin, unsur yang paling elektronegatif dan membutuhkan tambahan 1 elektron, mempunyai bilangan oksidasi -1 pada semua senyawanya.
3). Bilangan oksidasi unsur logam selalu bertanda positif (+).
Contoh :
Unsur golongan IA, IIA dan IIIA dalam senyawanya memiliki bilangan oksidasi berturut-turut +1, +2 dan +3.
4). Bilangan oksidasi suatu unsur dalam suatu ion tunggal = muatannya.
Contoh : bilangan oksidasi Fe dalam ion Fe3+ = +3
Perhatian :
Muatan ion ditulis sebagai B+ atau B-, sedangkan bilangan oksidasi ditulis sebagai +B atau –B.
5). Bilangan oksidasi H umumnya = +1, kecuali dalam senyawanya dengan logam (hidrida) maka bilangan oksidasi H = -1.
Contoh :
Bilangan oksidasi H dalam HCl, H2O, NH3 = +1
Bilangan oksidasi H dalam NaH, BaH2 = -1
6). Bilangan oksidasi O umumnya = -2.
Contoh :
Bilangan oksidasi O dalam senyawa H2O, MgO, BaO = -2.
Perkecualian :
a). Dalam F2O, bilangan oksidasi O = +2
b). Dalam peroksida, misalnya H2O2, Na2O2 dan BaO2, biloks O = -1.
c). Dalam superoksida, misalnya KO2 dan NaO2, biloks O = –
7). Jumlah biloks unsur-unsur dalam suatu senyawa netral = 0.
8). Jumlah biloks unsur-unsur dalam suatu ion poliatom = muatannya.
4. Penggolongan Reaksi Redoks Berdasarkan Perubahan Bilangan Oksidasi
a. Reaksi Bukan Redoks
Pada reaksi ini, b.o setiap unsur dalam reaksi tidak berubah (tetap).
Contoh :
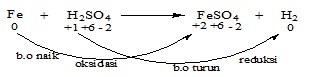
b. Reaksi Redoks
Pada reaksi ini, terjadi peningkatan dan penurunan b.o pada unsur yang terlibat reaksi.
Contoh :
Keterangan :
Oksidator = H2SO4
Reduktor = Fe
Hasil reduksi = H2
Hasil oksidasi = FeSO4
c. Reaksi Otoredoks ( Reaksi Disproporsionasi )
Pada reaksi ini, yang bertindak sebagai oksidator maupun reduktor’nya merupakan zat yang sama.
Contoh :
Keterangan :
Oksidator = I2
Reduktor = I2
Hasil reduksi = NaI
Hasil oksidasi = NaIO3
d. Reaksi Konproporsionasi
Pada reaksi ini, yang bertindak sebagai hasil oksidasi maupun hasil reduksi’nya merupakan zat yang sama.
5. Reaksi redoks dalam industri
Proses utama pereduksi bijih logam untuk menghasilkan logam didiskusikan dalam artikel peleburan. Oksidasi digunakan dalam berbagai industri seperti pada produksi produk-produk pembersih. Reaksi redoks juga merupakan dasar dari sel elektrokimia.
6. Reaksi redoks dalam biologi
Banyak proses biologi yang melibatkan reaksi redoks. Reaksi ini berlangsung secara simultan karena sel, sebagai tempat berlangsungnya reaksi-reaksi biokimia, harus melangsungkan semua fungsi hidup. Agen biokimia yang mendorong terjadinya oksidasi terhadap substansi berguna dikenal dalam ilmu pangan dan kesehatan sebagai oksidan. Zat yang mencegah aktivitas oksidan disebut antioksidan.
Pernapasan sel, contohnya, adalah oksidasi glukosa (C6H12O6) menjadi CO2 dan reduksi oksigen menjadi air. Persamaan ringkas dari pernapasan sel adalah:
C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
Proses pernapasan sel juga sangat bergantung pada reduksi NAD+ menjadi NADH dan reaksi baliknya (oksidasi NADH menjadu NAD+). Fotosintesis secara esensial merupakan kebalikan dari reaksi redoks pada pernapasan sel :
6 CO2 + 6 H2O + light energy → C6H12O6 + 6O2
Energi biologi sering disimpan dan dilepaskan dengan menggunakan reaksi redoks. Fotosintesis melibatkan reduksi karbon dioksida menjadi gula dan oksidasi air menjadi oksigen. Reaksi baliknya, pernapasan, mengoksidasi gula, menghasilkan karbon dioksida dan air.
Sebagai langkah antara, senyawa karbon yang direduksi digunakan untuk mereduksi nikotinamida adenina dinukleotida (NAD+), yang kemudian berkontribusi dalam pembentukan gradien proton, yang akan mendorong sintesis adenosina trifosfat (ATP) dan dijaga oleh reduksi oksigen. Pada sel-sel hewan, mitokondria menjalankan fungsi yang sama.
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia