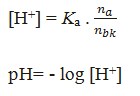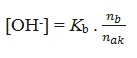Larutan Penyangga – Komponen, dan Menghitung pH Larutan Asam Basa – Sebagaimana diuraikan sebelumnya, jika ke dalam larutan garam yang kation atau anionnya terhidrolisis, misalnya larutan NH4Cl ditambahkan NH3 maka akan terbentuk kesetimbangan antara ion NH4+ dan NH3. Sistem larutan seperti ini dinamakan larutan buffer (penyangga). Salah satu sifat penting dari larutan penyangga adalah dapat mempertahankan pH larutan.

1. Pengertian Larutan Penyangga
Suatu larutan yang dapat menahan perubahan pH yang besar ketika ion-ion hidrogen atau hidroksida ditambahkan, atau ketika larutan itu diencerkan, disebut larutan buffer (penyangga).
Secara umum larutan penyangga mengandung asam basa konjugat. Yang diperlukan oleh larutan buffer adalah dua komponen; salah satu komponen mampu menetralkan asam, dan komponen lainnya mampu menetralkan basa.
Namun kedua komponen itu tidak saling menetralkan. Prasyarat ini meniadakan campuran asam kuat dan basa kuat. Jadi, larutan buffer biasa dideskripsikan sebagai gabungan dari :
- Asam lemah dan basa konjugatnya, atau
- Basa lemah dan asam konjugatnya
Baca Juga : 60+ Soal Larutan Penyangga Pilihan Ganda dan Jawaban [+Pembahasan]
Prinsip Larutan Penyangga
Berdasarkan Teori Asam-Basa Arrhenius, larutan yang mengandung campuran asam lemah dan garam yang anionnya senama dengan asam lemah tersebut akan membentuk larutan buffer. Contohnya, NH3COOH dan CH3COONa.
Demikian juga jika larutan mengandung campuran basa lemah dan garam yang kationnya senama dengan basa lemah akan membentuk buffer. Contohnya, NH4OH dan NH4Cl.
Berdasarkan Teori Asam-Basa Bronsted-Lowry, larutan yang mengandung campuran dari pasangan asam lemah dan basa konjugat atau basa lemah dan asam konjugatnya akan membentuk larutan penyangga.
Contoh:
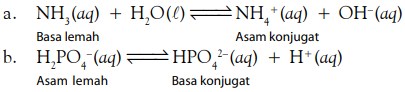
Prinsip larutan buffer berdasarkan teori asam basa Arrhenius terbatas hanya untuk campuran asam lemah dan garamnya atau basa lemah dan garamnya, sedangkan prinsip berdasarkan Bronsted-Lowry lebih umum, selain asam lemah dan garamnya (contoh a), juga mencakup campuran garam dan garam (contoh b).
Tinjau contoh (b), sistem kesetimbangan asam lemah dan basa konjugatnya dapat berasal dari garam NaH2PO4 dan Na2HPO4 . Jika kedua garam ini dicampurkan, akan terbentuk larutan buffer.
2. Komponen Larutan Penyangga
Secara umum, digambarkan sebagai campuran yang terdiri dari:
- Asam lemah (HA) dan basa konjugasinya (ion A-), campuran ini menghasilkan larutan bersifat asam.
- Basa lemah (B) dan asam konjugasinya (BH+), campuran ini menghasilkan larutan bersifat basa.
Komponen larutan buffer terbagi menjadi:
Larutan penyangga yang bersifat asam
Larutan ini mempertahankan pH pada daerah asam (pH < 7). Untuk mendapatkan larutan ini dapat dibuat dari asam lemah dan garamnya yang merupakan basa konjugasi dari asamnya. Adapun cara lainnya yaitu mencampurkan suatu asam lemah dengan suatu basa kuat dimana asam lemahnya dicampurkan dalam jumlah berlebih.
Campuran akan menghasilkan garam yang mengandung basa konjugasi dari asam lemah yang bersangkutan. Pada umumnya basa kuat yang digunakan seperti natrium (Na), kalium, barium, kalsium, dan lain-lain.
Larutan penyangga yang bersifat basa
Larutan ini mempertahankan pH pada daerah basa (pH > 7). Untuk mendapatkan larutan ini dapat dibuat dari basa lemah dan garam, yang garamnya berasal dari asam kuat. Adapun cara lainnya yaitu dengan mencampurkan suatu basa lemah dengan suatu asam kuat dimana basa lemahnya dicampurkan berlebih.
3. pH Larutan Penyangga
Sifat larutan buffer
a) Asam Lemah Dengan Basa Konjugasinya (Buffer Asam)
Misalnya, kedalam campuran larutan CH3COOH dan CH3COO– ditambahkan sedikit asam atau basa, yang terjadi adalah sebagai berikut.
Jika ditambahkan asam maka ion H+ dari asam akan bereaksi dengan ion CH3COO– membentuk CH3COOH menurut reaksi:
CH3COO–(aq) + H+(aq) → CH3COOH(aq)
Sehingga harga pH tetap.
Jika ditambahkan basa, ion OH– akan dinetralkan oleh CH3COOH menurut reaksi:
CH3COOH(aq)+ OH–(aq) → CH3COO–(aq) + H2O(l)
Sehingga harga pH tetap.
b) Basa Lemah Dengan Asam Konjugasinya (Buffer Basa)
Misalnya, kedalam campuran larutan NH3 dan NH4+ ditambahkan sedikit asam atau basa. Hal yang terjadi adalah sebagai berikut.
Jika ditambahkan asam ion H+ akan dinetralkan oleh NH3, menurut reaksi:
NH3(aq) + H+(aq) → NH4+
Sehingga harga pH tetap
Jika yang ditambahkan basa maka ion OH– akan bereaksi dengan ion NH4+ sebagai berikut.
NH4++ OH–(aq) → NH3(aq) + H2O(l)
Menentukan [H+] dan [OH–] Larutan Penyangga
a) Larutan buffer Asam Lemah Dengan Basa Konjugasinya (Buffer Asam)
Keterangan:
Ka = tetapan ionisasi asam lemah
na= Jumlah mol asam lemah
nbk= Jumlah mol basa konjugasinya
b) Larutan Penyangga Basa Lemah Dengan Asam Konjugasinya (Buffer Basa)
Keterangan:
Ka = tetapan ionisasi asam lemah
nb= Jumlah mol basa lemah
nak= Jumlah mol asam konjugasinya
pOH= – log [OH–]
pH= 14- pOH
c) Pengaruh pengenceran, penambahan sedikit asam, dan basa terhadap pH larutan penyangga
pH suatu larutan penyangga ditentukan oleh komponen-komponennya. Komponen-komponen itu dalam perhitungan membentuk perbandingan tertentu. Jika campuran tersebut diencerkan, maka harga perbandingan komponen-komponennya tidak berubah sehingga pH larutan juga tidak berubah.
Secara teoritis, berapapun tingkat pengenceran tidak akan merubah pH. Akan tetapi dalam praktiknya, jika dilakukan pengenceran yang berlebihan, maka pH larutan penyangga akan berubah.
V1M1=V2M2
Keterangan:
V1 : Volume sebelum pengenceran
M1 : Molaritas sebelum pengenceran
V2 : Volume sesudah pengenceran
M2 : Molaritas sesudah pengenceran
4. Fungsi Larutan Penyangga
a) Dalam Tubuh Makhluk Hidup
Dalam tubuh manusia terdapat sistem penyangga yang berfungsi untuk mempertahankan harga pH, misalnya sebagai berikut.
- Dalam darah terdapat sistem penyangga, antara lain asam bikarbonat, hemoglobin (HhbO2).
- Dalam sel darah merah terdapat sistem penyangga sebagai berikut.
H2PO4–(aq) + H2O(l) → HPO42-(aq) + H3O+(aq)
b) Dalam Kehidupan Sehari-Sehari
Larutan buffer dalam kehidupan sehari-hari digunakan dalam berbagai bidang, seperti biokimia, bakteriologi, kimia analisis, industri farmasi, juga dalam fotografi dan zat warna. Dalam industri farmasi, larutan buffer digunakan pada pembuatan obat-obatan, agar obat tersebut mempunyai pH tertentu dan tidak berubah.
Pengendalian pH penting dalam proses industri. Contohnya, dalam pelumatan barley malt, langkah pertama pembuatan bir, pH larutan harus dipertahankan pada 5,0 sampai 5,2 agar enzim protease dan peptidase dapat menghidrolisis enzim dari barley.
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia