Hidrokarbon dan Minyak Bumi – Rumus, Sifat dan Contohnya – Senyawa organik yang hanya mengandung atom karbon dan hidrogen disebut hidrokarbon. Masyarakat menggunakan hidrokarbon ini untuk minyak dan sumber bahan mentah yang murah. Hidrokarbon terdapat dialam terutama sebagai gas alam dan minyak mentah (crude oil).

Kebanyakan dari minyak-minyak yang kita pakai seperti bensin, minyak tanah dan minyak bakar didapat dari permurnian minyak mentah yaitu suatu campuran senyawa kompleks yang kebanyakan terdiri dari hidrokarbon. Gas alam yang mengandung 60% – 90% gas metana adalah bahan bakar yang biasa dipakai dalam rumah tangga atau gedung- gedung.Minyak mentah dan gas alam menghasilkan juga bahan mentah untuk industri petrokimia suatu industri yang menghasilkan 90% lebih bahan kimia organik.
Simak Juga : Soal Hidrokarbon Pilihan Ganda dan Jawaban
A. Pengertian Senyawa Hidrokarbon
Senyawa hidrokarbon merupakan suatu senyawa yang tersusun oleh atom karbon ( C ) dan atom hidrogen ( H ). Senyawa hidrokarbon banyak sekali kegunaannya dalam kehidupan sehari-hari.
Terbentuknya senyawa hidrokarbon melalui suatu ikatan yang dinamakan ikatan kovalen. Ikatan kovalen adalah suatu ikatan yang terjadi sesama atom bukan logam. Atom C mempunyai 4 elektron di kulit terluar. Atom C cenderung memiliki kaidah oktet (8 elektron ), sedangkan atom H cenderung memiliki kaidah dupled ( 2 elektron ) pada kulit terluarnya.
B. Kekhasan Atom Karbon
Atom karbon mempunyai keistimewaan dapat membentuk persenyawaan yang stabil yang begitu besar jumlahnya, sebab atom karbon mempunyai beberapa kekhasan, yaitu:
Atom karbon dapat membentuk empat ikatan kovalen
Atom karbon mempunyai nomor atom 6. Di dalam sistem periodik atom karbon terletak pada golongan IVA periode 2. Konfigurasi atom karbon adalah sebagai berikut:
Kulit K L
6C = 2 4
Berdasarkan konfigurasi tersebut, atom karbon mempunyai 4 elektron terluar (elektron valensi). Agar susunan elektronnya stabil sesuai dengan kaidah oktet (mempunyai 8 elektron terluar), atom karbon memerlukan 4 elektron. Sehingga atom karbon dapat membentuk empat buah ikatan kovalen.
Banyaknya atom H yang dapat berikatan dengan atom C, supaya atom C memenuhi kaidah okted adalah 4. Hal ini dapat digambarkan sebagai berikut :
6C : 2 4
1H : 1
Banyaknya elektron di kulit terluar atom C dapat digambarkan : dan atom H digambarkan dengan : Hx. Atom C berikatan dengan atom H, sebagai berikut :
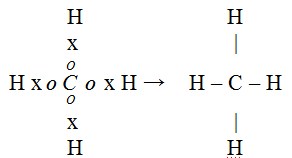
Atom karbon dapat membentuk senyawa yang stabil
Dalam persenyawaannya, atom karbon membentuk empat pasang elektron ikatan dengan atom-atom lain, sehingga lengkaplah pembentukan oktetnya tanpa adanya pasangan elektron bebas. Akibatnya persenyawaan atom karbon sangat stabil.
Atom karbon dapat membentuk ikatan tunggal dan rangkap
Keempat elektron valensi yang dimiliki oleh atom karbon dapat membentuk ikatan tunggal, ikatan rangkap, dan ikatan rangkap tiga.
Atom karbon dapat membentuk rantai lurus dan bercabang
Kekhasan atom karbon yang tidak dimiliki atom lain adalah kemampuan membentuk rantai yang sangat panjang antar sesama atom karbon. Rantai karbon tersebut dapat lurus dan bercabang.
C. Macam-macam Senyawa Hidrokarbon
Berdasarkan jenis ikatannya :
- Ikatan tunggal ( Hidrokarbon jenuh )
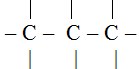
- Ikatan rangkap : ( Hidrokarbon tak jenuh )
rangkap 2 ( Alkena )
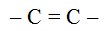
rangkap 3 ( Alkuna )
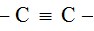
Berdasarkan bentuk rantainya :
Rantai terbuka ( alifatik)
Suatu senyawa hidrokarbon yang ada pangkal dan ujungnya, digambar dengan :
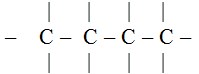
Rantai tertutup ( siklik )
Suatu senyawa hidrokarbon yang tidak ada pangkal dan ujungnya, digambar dengan:
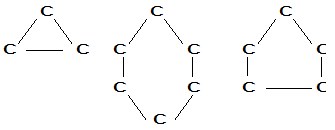
Berdasarkan jumlah atom karbon yang diikat oleh atom karbon lainnya :
- (1) Atom C primer : atom C yang diikat oleh satu atom C yang lain.
- (2) Atom C sekunder : atom C yang diikat oleh dua atom C yang lain.
- (3) Atom C tersier : atom C yang diikat oleh tiga atom C yang lain.
- (4) Atom C kuartener : atom C yang diikat oleh empat atom C yang lain.
Digambarkan sebagai berikut :
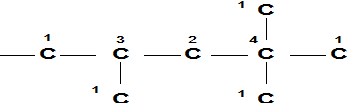
D. Pembagian Senyawa Hidrokarbon
Alkana
Alkana merupakan senyawa hidrokarbon jenuh yang seluruh ikatannya tunggal. Sebagai hidrokarbon jenuh, alkana memiliki jumlah atom H yang maksimum. Alkana juga dinamakan parafin (dari parum affinis), karena sukar bereaksi dengan senyawa-senyawa lainnya. Kadang-kadang alkana juga disebut sebagai hidrokarbon batas, karena batas kejenuhan atom-atom H telah tercapai.
Setiap senyawa yang merupakan anggota alkana dinamakan suku. Suku alkana ditentukan oleh jumlah atom C dalam senyawa tersebut. Suku pertama alkana adalah metana, CH4. Dalam molekul metana satu atom C terikat pada 4 atom H. Metana dapat menurunkan senyawa alifatik lainnya. Jika satu atom H pada metana diganti dengan atom C, maka akan terbentuk suku kedua alkana, yaitu etana. Berdasarkan tetravalensi atom C, maka atom C kedua akan mengikat 3 atom H, sehingga rumus molekul etana adalah C2H6
Alkana adalah senyawa hidrokarbon yang seluruh ikatannya adalah ikatan tunggal (ikatan jenuh), digambarkan dengan :
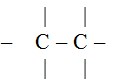
Rumus umum :
CnH2n+2
Rumus molekul dan nama 10 senyawa pertama alkana adalah sebagai berikut :

Rumus Bangun Alkana
Rumus bangun adalah rumus yang menggambarkan jumlah atom sebenarnya dari rumus molekul senyawa hidrokarbon. Contoh rumus bangun senyawa etana C2H6
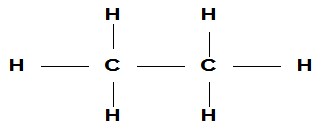
Dapat disederhanakan menjadi H3C – CH3
E. Tata Nama Alkana
Perbedaan rumus struktur alkana dengan jumlah C yang sama akan menyebabkan berbedaan sifat alkana yang bersangkutan. Banyaknya kemungkinan struktur senyawa karbon, menyebabkan perlunya pemberian nama yang dapat menunjukkan jumlah atom C dan rumus strukturnya. Aturan pemberian nama hidrokarbon telah dikeluarkan oleh IUPAC agar dapat digunakan secara internasional.
Rantai tidak bercabang (lurus)
Jika rantai karbon terdiri dari 4 atom karbon atau lebih, maka nama alkana diberi awalan n- (normal)
CH3 – CH2 – CH2 – CH2 – CH3 = n-pentana
Jika rantai karbon bercabang, maka:
- Tentukan rantai induk ( rantai utama ), yaitu rantai karbon terpanjang dari ujung satu ke ujung yang lain. Rantai induk diberi nama alkana.
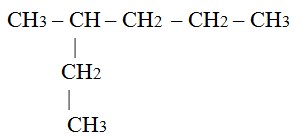
Rantai utama ada 6 rantai karbon, sehingga di beri nama heksana
- Penomoran. Berilah nomor pada rantai induk dari ujung terdekat cabang
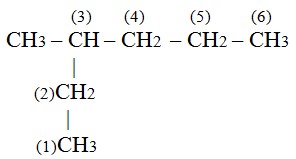
Jika nomor dari bawah, maka cabang ada di nomor 3. tetapi jika dari kanan, maka cabang ada di nomor 4. Sehingga dipilih penomoran dari ujung bawah.
- Tentukan cabang, yaitu atom C yang yang terikat pada rantai induk.Cabang merupakan gugus alkil dan beri nama alkil sesuai struktur alkilnya. Perhatikan beberapa gugus alkil berikut:
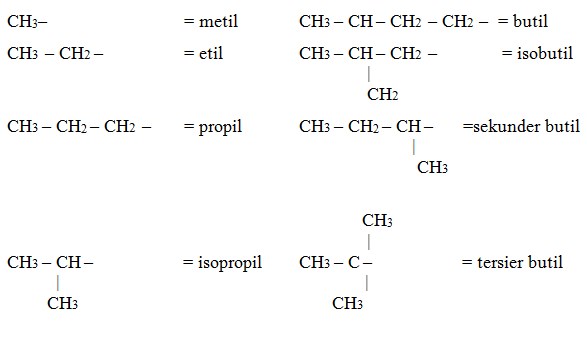
Urutan penulisan nama. Urutan penulisan nama untuk alkana bercabang: Nomor cabang-nama cabang nama rantai induk:Nama untuk struktur di atas adalah: 3-metilheksana– jika terdapat lebih dari satu alkil sejenis, maka tulis nonor-nonor cabang dari alkil sejenis dan beri awalan alkil dengan di, tri, tetra, penta dan seterusnya sesuai dengan jumlah alkil sejenis.
Isomer Alkana
Isomer adalah suatu senyawa hidrokarbon yang memiliki rumus kimia sama tetapi rumus bangun berbeda.
Contoh : senyawa butana C4H10 memiliki dua buah isomer yaitu :
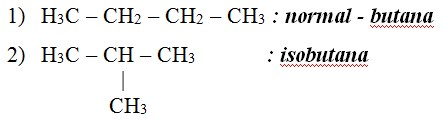
Alkil
Adalah sautu senyawa hidrokarbon yang kehilangan satu atom hidrogen.
Rumus umum :
CnH2n+1
Nama senyawa alkil, sama dengan senyawa alkana hanya dengan mengganti akhiran –ana menjadi –il.
Contoh :
- 1) CH4 menjadi CH3
Metana > metil
- 2) C2H6 menjadi C2H5
etana > etil
Alkena
Alkena adalah suatu senyawa hidrokarbon yang mengandung ikatan rangkap (ikatan tak jenuh), digambarkan dengan :
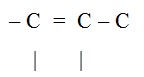
Rumus umum : CnH2n
Tata nama senyawa alkena sama dengan senyawa alkana, dengan mengganti akhiran -ana pada alkana menjadi –ena.
Contoh :
- 1) C2H6 menjadi C2H4
etana > etena
- 2) C3H8 menjadi C3H6
propana > propena
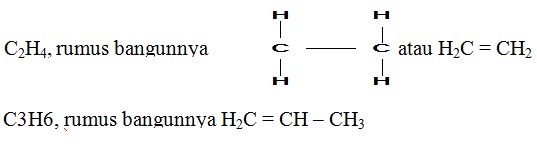
Rumus Bangun Alkena
Rumus bangun pada senyawa alkena mengandung 1 buah ikatan rangkap 2.
Contoh :
Aturan tata nama senyawa alkena :
- Akhiran –ana pada alkana diganti dengan akhiran –ena
- Rantai utama merupakan rantai atom C terpanjang yang mengandung ikatan rangkap.
Contoh :
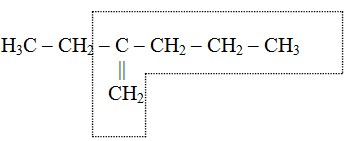
- Penomoran rantai utama dimulai dari ujung rantai sedemikian rupa sehingga posisi ikatan rangkap mendapat nomor terkecil.
Contoh :
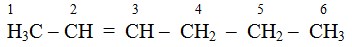
- Penulisan cabang-cabang dan aturan yang lain, misalnya mengandung cabang 2 yang sama ditambah awalan di- , cabang 3 yang sama ditambah awalan tri-, pada nama cabang alkilnya.
Contoh :
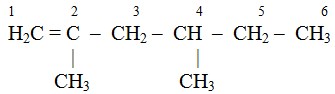
Isomer Alkena
Isomer pada alkena mulai terdapat pada butena (C4H8) yang mempunyai 3 buah isomer, yaitu :
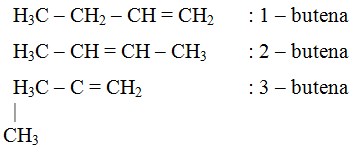
Alkuna
Alkuna adalah suatu senyawa hidrokarbon yang memiliki satu buah ikatan rangkap 3 ( – C ≡ C – ) dengan rumus umum CnH2n-2
Tata nama senyawa alkuna :
- Akhiran –ana pada alkana diganti dengan akhiran –una.
- Rantai utama merupakan rantai atom C terpanjang yang mengandung ikatan rangkap 3.
Contoh :
HC ≡ C – CH2 – CH2 – CH2 – CH3
- Penomoran rantai utama dimulai dari ujung rantai sedemikian rupa sehingga posisi ikatan rangkap 3 mendapat nomor terkecil.
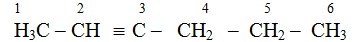
- Penulisan cabang-cabang dan aturan yang lain seperti pada senyawa lainnya
Rumus Bangun Alkuna
Rumus bangun senyawa alkuna mengandung 1 buah ikatan rangkap 3 ( – C ≡ C – )
Contoh : butuna ( C4H6 ) : H3C – CH ≡ CH3
Isomer Alkuna
Isomer struktur pada alkuna mulai terdapat pada butuna yang memiliki 2 buah isomer yaitu :
- CH3 – CH2 – C ≡ CH : 1- butuna
- CH3 – C ≡ C – CH3 : 2- butuna:
F. Minyak Bumi
Pembentukan minyak bumi dan gas alam
Minyak bumi dan gas alam berasal dari pelapukan jasad renik baik hewan maupun tumbuhan yang terkubur dalam kerak bumi selama jutaan tahun. Akibat pengaruh suhu dan tekanan tinggi bakteri an-earob menguraikan sisa-sisa organisme tersebut menjadi minyak dan gas alam yang terkumpul dalam pori-pori batu kapur.
Komponen utama penyusun minyak bumi
Minyak bumi terdiri atas campuran dari berbagai macam hidrokarbon. Komponen utama minyak bumi adalah alkana dan sikloalkana. Minyak bumi juga mengandung senyawa-senyawa nitrogen 0,01 – 0,9 %, belerang 0,1 – 7 %, oksigen 0,06 – 0,4 %.
Hidrokarbon yang terkandung dalam minyak bumi mentah yang berupa alkana antara lain metana, etana, propana sampai alkana berantai panjang lurus dan bercabang. Alkana bercabang yang terpenting adalah iso oktana atau 2,2,4 trimetil pentana.
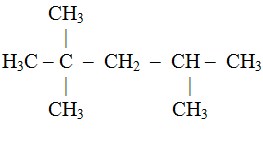
Dasar dan teknik pemisahan fraksi-fraksi minyak bumi
Minyak bumi diperoleh dari hasil pengeboran merupakan minyak mentah (crude oil) yang berupa zat cair kental berwarna hitam.
Pengolahan atau pemisahan komponen penyusun minyak bumi dilakukan dengan cara destilasi bertingkat, berdasarkan perbedaan titik didih fraksi-fraksi penyusun minyak bumi. Mula-mula minyak dipanaskan sampai suhu + 4000 C kemudian dipompakan ke menara fraksionisasi.
Masing-masing fraksi akan memisah pada suhu yang berbeda-beda. Hasil destilasi bertingkat minyak bumi diperoleh fraksi-fraksi minyak bumi seperti ditunjukkan dalam tabel berikut ini :
Tabel fraksi-fraksi hasil destilasi bertingkat minyak bumi
| Fraksi | Jumlah Atom | Titik didih (0C) | Kegunaan |
| Gas | C1 – C5 | < 30 | Bahan bakar gas (LPG) dan bahan dasar petrokimia |
| Petroleum eter | C5 – C7 | 30 – 90 | Pelarut |
| Bensin (gasoline) | C5 – C12 | 40 – 180 | Bahan bakar motor, mobil |
| Minyak tanah | C12 – C16 | 180 – 250 | Bahan bakar kompor, lampu |
| Solar (diesel) | C15 – C18 | 250 – 350 | Bahan bakar mesin diesel |
| Minyak pelumas | C16 – C24 | > 350 | Pelumas |
| Lilin (parafin) | C21 – C50 | – | Alat penerangan, bahan lilin |
| Aspal (residu) | C50 ke atas | – | Pelapis jalan raya |
Kualitas bensin
Bensin merupakan salah satu fraksi minyak bumi yang paling banyak diproduksi dan digunakan sebagai bahan bakar kendaraan bermotor dan mobil. Bensin mengandung campuran isomer-isomer heptana (C7H16) dan oktana (C8H18).
Bensin yang banyak mengandung hidrokarbon rantai lurus (misal heptana) sangat mudah terbakar dalam mesin motor bakar sehingga akan menimbulkan bunyi ketukan (knocking) yang mengakibatkan mesin mudah rusak.
Kualitas bensin ditentukan oleh jumlah ketukan yang ditimbulkannya dan dinyatakan dengan bilangan oktan. Makin sedikit jumlah ketukan maka makin tinggi bilangan oktannya, yang berarti makin baik kualitas bensin.
Bilangan oktan adalah bilangan yang menunjukkan persen volume iso oktana dalam bensin. Untuk menetapkan bilangan oktan telah ditetapkan dua senyawa sebagai pembanding, yaitu iso oktana ( 2,2,4 trimetil pentana) dan n-heptana.
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia




Alhamdulillah, terima kasih, sangat membantu sekali web ini. Insya Allah menjadi amal jariah