Kelarutan dan Hasil Kali Kelarutan (KSP) – Tetapan, Hubungan dan Contohnya – Jika kita melarutkan padatan garam dapur ke dalam air sedikit demi sedikit, pada awalnya NaCl larut seluruhnya dalam air. Ketika sejumlah tertentu NaCl telah melarut dan ada sebagian yang tidak larut (terbentuk endapan), maka larutan tersebut merupakan larutan jenuh atau tepat jenuh. Konsentrasi zat terlarut di dalam larutan jenuh sama dengan kelarutannya. Dengan demikian, kelarutan (solubility) –dengan lambang s– dapat didefinisikan sebagai jumlah maksimum suatu zat yang dapat larut dalam pelarut tertentu. Satuan kelarutan biasanya dinyatakan dalam gram/ Liter atau mol/ Liter.

Simak Juga : Soal KSP (Kelarutan dan Hasil Kali Kelarutan) dan Pembahasan
A. Kelarutan (Solubility)
Istilah kelarutan (solubility) digunakan untuk menyatakan jumlah maksimal zat yang dapat larut dalam sejumlah tertentu pelarut. Kelarutan dinyatakan dalam mol/liter. Jadi, kelarutan sama dengan kemolaran dalam larutan jenuhnya. Contohnya, .kelarutan AgCl dalam air sebesar 1 x 10-5 mol L-1
B. Tetapan Hasil Kali Kelarutan
Dalam suatu larutan jenuh dari suatu elektrolit yang sukar larut, terdapat kesetimbangan antara zat padat yang tidak larut dan ion-ion zat itu yang larut.
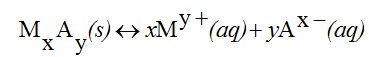
Karena zat padat tidak mempunyai molaritas, maka tetapan kesetimbangan reaksi di atas hanya melibatkan ion-ionnya saja, dan tetapan kesetimbangannya disebut tetapan hasil kali kelarutan (Ksp) (James E. Brady, 1990).
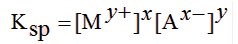
C. Hubungan Kelarutan Dan Tetapan Hasil Kali Kelarutan
Oleh karena s dan Ksp sama-sama dihitung pada larutan jenuh, maka antara s dan Ksp ada hubungan yang sangat erat. Jadi, nilai Ksp ada keterkaitannya dengan nilai s. Secara umum hubungan antara kelarutan (s) dengan tetapan hasil kali kelarutan (Ksp) untuk larutan elektrolit AxBy dapat dinyatakan sebagai berikut.
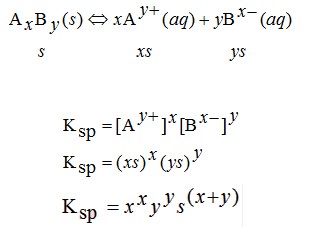
Contoh soal 1:
Sebanyak 4,35 mg Ag2CrO4 dapat larut dalam 100 ml air. Nyatakan kelarutan Ag2CrO4 tersebut dalam mol L-1 . (Ar O = 16; Cr = 52; Ag = 108)
Pembahasan :
Kelarutan = Molaritas larutan jenuh ; s = n/V
Mol Ag2CrO4 = Massa Ag2CrO4/Mr Ag2CrO4
= 4,35 x 10-3 gram /332 gram/mol
= 1,31 x 10-5 mol
Kelarutan (s) = mol / volume
= 1,31 x 10-5 mol /0,1 L
= 1,31 x 10-4 mol L-1
Contoh soal 2 :
Tuliskan rumus tetapan hasil kali kelarutan untuk senyawa Mg(OH)2!
Pembahasan:
Mg(OH)2 dalam larutan akan terurai menjadi ion-ionnya,
Mg(OH)2 ⇄ Mg2+ + 2OH–
Maka dari rumus Ksp diperoleh Ksp = [Mg2+][OH–]2
Contoh soal 3 :
Pada suhu tertentu, kelarutan AgIO3 adalah 2 × 10–6 mol/L, tentukan harga tetapan hasil kali kelarutannya!
Pembahasan:

Contoh soal 4 :
- Bila diketahui Ksp Ag2CrO4 = 4.10-12 maka konsentrasi CrO4 dalam larutan jenuh AgCrO4 adalah
Pembahasan:
Ag2CrO4 ⇄ 2Ag+ + CrO42-
s 2s s
Ksp = (Ag+)2(CrO42-)
4.10-12 = (2s)2(s)
4.10-12 = 4s3
10-12 = s3
s = 10-4( CrO42-)
s = 10-4
D. Pengaruh Ion Senama Terhadap Kelarutan
Ion senama adalah ion yang sejenis dengan ion-ion yang ada dalam sistem keseimbangan. Untuk menerapkan rumus ion senama harus menggunakan asas. Asas yang dimaksud adalah Asas Le Chatelier. Asas Le Chatelier adalah asas yang digunakan untuk memprediksi pengaruh perubahan kondisi pada kesetimbangan kimia. Asas atau prinsip ini dinamai sesuai dengan nama penemunya yaitu Henry Louis Le Chatelier (1850-1936). Dimana, bunyi asas Le Chatelier adalah “Jika terhadap suatu sistem kesetimbangan dilakukan suatu tindakan (aksi), sistem kesetimbangan tersebut akan mengalami perubahan (pergeseran) yang cenderung untuk mengurangi pengaruh aksi tersebut.”
Kita ambil contoh larutan jenuh AgCl. Pada saat AgCl dilarutkan dalam air, maka akan terbentuk reaksi kesetimbangan, yaitu:
AgCl(s) ⇄ Ag+(aq) + Cl–(aq)
Adanya penambahan larutan AgNO3 akan memperbesar konsentrasi ion Ag+ karena AgNO3 juga akan terionisasi dan menghasilkan ion Ag+.
Reaksi yang terjadi yaitu:
AgNO3(aq) ⇄ Ag+(aq) + NO3–(aq)
Sementara itu, penambahan ion sejenis (Ag+) akan menggeser kesetimbangan ke kiri. Pergeseran ke kiri menyebabkan kelarutan AgCl berkurang, tetapi tidak mempengaruhi harga tetapan hasil kali kelarutan, jika suhu tidak berubah.
Kesimpulan :
- Keberadaan ion senama atau sejenis dalam suatu larutan justru akan memperkecil kelarutan (s)
- Ion senama tidak akan mempengaruhi besarnya Ksp, selama suhu tidak berubah (tetap).
E. Penerapan Ion Senama Terhadap Kelarutan
Pembentukan Stalaktit dan Stalagmit
Di daerah batu kapur, gua terbentuk oleh air hujan yang mengandung gas karbon dioksida (CO2) yang di serap dari atmosfer.batu kapur tersusun dengan bahan utama kalsium karbonat (CaCO3). Kalsium karbonat larut oleh asam lemah. Kemudian membentuk saluran, saluran dalam jangka waktu yang lama. Reaksi kimia ini merupakan reaksi kesetimbangan.
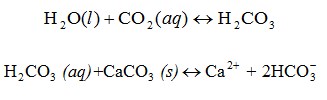
Karena merupakan reaksi kesetimbangan, reaksi tersebut dapat mengalami pergeseran sehingga membetuk stalagmit dan stalaktit. Stalagmit adalah batuan seperti es yang tumbuh dari dasar gua akibat tetesan, sedangkan stalaktit adalah batuan mirip es yang menggantung di atap gua.
Pembentukan pilar stalaktit dan stalagmite terjadi ketika air mengandung kalsium karbonat menguapa secara berulang-ulang. Dengan kata lain, jumlah CaCO3 berkurang. Menurut prinsip Le Chatelier, jika konsentrasi zat berkurang, reaksi akan bergeser ke arah zat yang berkurang tersebut. Jadi, reaksi akan bergeser ke kiri (pembentukan CaCO3). Hal itu dapat di amati dari jatuhnya larutan Ca2+ dan HCO3– yang berada di atap gua. Penguapan dalam gua terjadi dalam waktu yang sangat lambat. Penyebabnya, karena tidak ada radiasi matahari untuk menarik molekul air, kecilnya pergerakan udara bahkan hampir tidak ada, dan hampir semua udara yang jenuh dengan uap air. Pertambahan panjang stalaktit hanya 0.2 mm pertahun. Lambatnya laju pengendapan ini juga di pengaruhi oleh gerakan udara dan campuran di dalam batu kapur.
Pembentukan Kerang Mutiara
Mutiara terbentuk ketika suatu Objek Mikroskopis, (misalnya pasir) masuk ke dalam kulit kerang mutiara (Pinctada maxima)
Yang terbentuk dengan reaksi kesetimbangan :
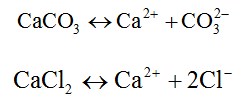
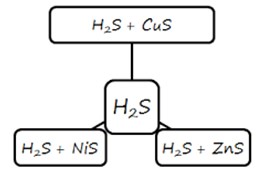
Pemisahan Logam dengan Sulfida
Pemisahan Logam dengan Ion Sulfida dilakukan dengan mencampurkan Ion Sulfida (H2S) ke dalam logam yang telah digali.
Contoh soal:
Pada suhu tertentu, kelarutan AgIO3 adalah 2 × 10–6 mol/L, tentukan harga tetapan hasil kali kelarutannya!
Pembahasan:
Ksp Ag2CrO4 = 4 s3 = 4(10–4)3 = 4 × 10–12
Ksp Ag2CrO4 = [Ag+]2 [CrO42-]
4 × 10–12 = [Ag+]2 × 10–2
[Ag+] = 2 × 10–5 M
Ag2CrO4 ⟶ 2Ag+ + CrO42-
Kelarutan Ag2CrO4 = × 2 × 10–5 = 10–5 M
Jadi, kelarutan Ag2CrO4 dalam larutan K2CrO4 adalah 10–5 M.
F. Pengaruh pH Terhadap Kelarutan
Istilah kelarutan (solubility) digunakan untuk menyatakan jumlah maksimum zat yang dapat larut dalam sejumlah tertentu pelarut. Kelarutan (khususnya untuk zat yang sukar larut) dinyatakan dalam mol L-1. Jadi, kelarutan sama dengan kemolaran dari larutan jenuhnya. Tetapan kesetimbangan dari kesetimbangan antara garam atau basa yang sedikit larut disebut tetapan hasil kali kelarutan (solubility product constant) dan dinyatakan dengan lambing Ksp.
Jika garam CaF2 dan garam AgCl dilarutkan dalam air, maka garam akan melarut dan membentuk ion-ionnya.
CaF2 (s) ⇄ Ca2+ (aq) + 2F– (aq)
AgCl(s) ⇄Ag+(aq) + Cl–(aq)
Apakah hanya reaksi kesetimbangan diatas yang terjadi bila kalian melarutkan kedua garam tersebut dalam air? Anion F– yang terbentuk dari garam CaF2 merupakan basa konjugasi dari asam lemah HF, sehingga akan terhidrolisis dalam air melepas ion OH–. Kesetimbangan yang terjadi:
F–(aq) + H2O (l) ⇄ HF (aq) + OH– (aq)
Karena terdapat OH– dalam larutan. Lalu bagaimanakah pada anion Cl–? anion ini merupakan basa konjugasi dari asam kuat HCl maka di dalam air tidak akan terhidrolisis. Lalu apakah kelarutan AgCl akan berpengaruh jika terjadi perubahan pH?
pH dan Kelarutan Basa
Jika pH ↑, artinya konsentrasi OH– ↑
Maka kesetimbangan bergeser ke kiri, kelarutan ↓
Mg(OH)2 (s)⇄Mg2+(aq) + 2OH–(aq)
Jika pH ↓, artinya konsentrasi OH– ↓
Maka kesetimbangan bergeser ke kiri, kelarutan ↑
Pada umumnya basa mudah larut dalam larutan asam, tetapi sebaliknya akan sukar larut dalam larutan basa. Jika kedalam larutan basa ditambahkan asam, maka konsentrasi ion H+ akan bertambah dan konsentrasi ion OH– akan berkurang. Jika ion OH– berkurang maka kelarutannya juga akan berkurang. Jika larutan ditambahkan basa, maka konsentasi OH– akan bertambah sehingga kelarutannya juga akan bertambah.
pH dan Kelarutan Garam
Perubahan pH hanya akan berpengaruh apabila garam sukar larut berasal dari asam lemah atau garam yang terhidrolisis sebagian dari asam lemah dan basa kuat.
Barium karbonat (BaCO3) merupakan salah satu endapan yang sukar larut dalam air, maka keseimbangan berikut ini akan terjadi dalam larutan:
- Anion CO32- adalah anion dari asam lemah yang dapat terhidrolisis
Jika pH ↑, artinya [OH–] ↑
Kesetimbangan akan bergeser ke arah kiri dan [CO32-] ↑
CO32-(aq)+ H2O(l) ⇄ H (aq) + OH–(aq)
Jika pH ↓, artinya [OH–] ↓
Kesetimbangan akan bergeser ke arah kiri dan [CO32-] ↓
Kemudian dalam persamaan berikut:
Jika pH ↑, maka [CO32-] ↑ sehingga
Kesetimbangan bergeser ke kiri, kelarutan ↓
BaCO3(s) ⇄ Ba2+(aq) + (aq)
Jika pH ↓, maka [CO32-] ↓ sehingga
Kesetimbangan bergeser ke kanan, kelarutan ↑
- Kalsium karbonat (CaCO3) sukar larut dalam air, tetapi larut dalam larutan HCl.
Fakta ini dapat diterangkan sebagai berikut:
Dalam larutan jenuh CaCO3 terdapat kesetimbangan sebagai berikut.
CaCO3 (s) ↔ Ca2+ (aq) + CO32-(aq)
Dalam larutan asam, ion akan diikat oleh ion H+ membentuk HCO3–atau H2CO3. H2CO3 selanjutnya akan terurai membentuk CO2 dan H2O. Hal ini akan menggeser kesetimbangan di atas ke kanan atau dengan kata lain’ menyebabkan CaCO3 melarut.
G. Reaksi Pengendapan
Reaksi pengendapan (presipitasi) adalah reaksi pembentukan padatan dalam larutan atau di dalam padatan lain selama reaksi kimia. Pengendapan yang dapat terjadi karena adanya difusi dalam padatan. Ketika reaksi terjadi dalam larutan cair, padatan terbentuk disebut sebagai endapan. Bahan kimia yang menyebabkan adanya padatan disebut pengendap. Tanpa kekuatan energi gravitasi yang cukup untuk membawa partikel-partikel padat ke bawah bersama-sama, maka endapan akan tetap sebagai suspense. Setelah terjadi sedimentasi, endapan dapat disebut sebagai pellet. Cairan yang sudah tidak mempunyai endapan supernatant.
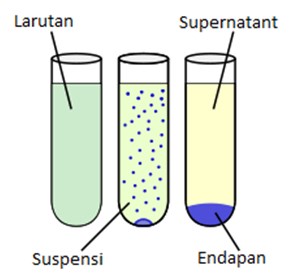
Pengendapan dapat terjadi jika konsentrasi senyawa melebihi kelarutan. Pengendapan dapat terjadi dengan cepat dari larutan jenuh. Pengendapan erat kaitannya dengan hasil kali kelarutan (Ksp). Dalam padatan, pengendapan terjadi jika konsentrasi salah satu padatan berada di atas batas kelarutan.
Jenis Reaksi Pengendapan
Persamaan Molekul
Persamaan molekul adalah persamaan yang menulis bahwa semua spesi-spesi di anggap sebagai molekul, maupun semua senyawa di tulis tanpa harus menulis senyawa yang berperan dalam suatu keberlangsungan reaksi pengendapan.
Contoh:
Reaksi antara natrium sulfat dengan barium klorida menghasilkan endapan barium sulfat dalam larutan natrium klorida.
Na2SO4(aq) + BaCl2(aq) → BaSO4(s) + 2NaCl (aq)
Persamaan Ionik
Persamaan ionik adalah persamaan yang menunjukkan spesi-spesi yang terlarut dalam bentuk ion-ion bebas. Untuk ion-ion yang tidak terlibat dalam reaksi disebut ion pendamping. Karena ion pendamping muncul pada kedua ruas persamaan dan tidak berubah selama reaksi kimia sehingga dapat diabaikan. Contoh:
Pb2+(aq) + 2NO3–(aq) + 2Na+(aq) + 2I–(aq) → PbI2(s) + 2Na+(aq) + 2NO3–(aq)
Ion-ion Na+ dan NO3– adalah sebagai ion pendampingnya. karena dalam penulisan persamaan rumus reaksi pengendapan kita memerlukan pemusatan terhadap perubahan yang sebenarnya terjadi maka di perlukan persamaan ionik total.
Persamaan Ionik Total
Persamaan ionik total adalah persamaan reaksi yang menunjukkan hanya spesi-spesi yang benar-benar berperan dalam suatu reaksi. Contoh:
Pb2+(aq) + 2NO3–(aq) + 2Na+(aq) + 2I–(aq) → PbI2(s) + 2Na+(aq) + 2NO3–(aq)
Persamaan ionik total dari persamaan reaksi diatas adalah,
Pb2+(aq) + 2I–(aq) → PbI2(s)
Sehingga hanya ion-ion yang menyebabkan terbentuknya endapan saja yang di tulis. Suatu persamaan reaksi yang memiliki persamaan ionik total hanya yang dapat menghasilkan endapan saja, untuk reaksi yang tidak menghasilkan endapan tidak memiliki persamaan ionik total.
Zat Pengendap
Zat pengendap atau precipitating agent adalah zat tertentu yang ditambahkan ke dalam reaksi sehingga bisa menghasilkan endapan. Berikut adalah senyawa yang dapat diendapkan oleh zat-zat pengendap tertentu:
- Senyawa Hidroksida dan Garam
Senyawa – senyawa hidroksida dan garam bisa diendapkan dengan cara menaikkan pH larutan secara perlahan – lahan. Biasanya larutan amonia (NH3) dengan perbandingan 1 : 1 sering digunakan untuk tujuan ini di banyak percobaan laboratorium.
- Barium, Strontium, dan Kalsium
Ketiga unsur diatas adalah unsur golongan IIA. Sebagaimana yang kita ketahui bahwa senyawa – senyawa sulfat yang dibentuk oleh unsur – unsur ini adalah sukar larut dalam air dan akhirnya mengendap. Oleh karena itu, metode terbaik yang digunakan untuk mengendapkan ketiganya adalah dengan menggunakan zat pengendap yang bisa menghasilkan ion sulfat (SO42-) seperti asam sulfatmik dan dimetil sulfat. Asam sulfamik ketika dilarutkan ke dalam air bisa membebaskan ion sulfat yang kemudian akan bereaksi dengan barium, stontium atau kalsium membentuk endapan.
NH2SO3H + H2O → NH4+ H++ SO42-
Ca2+ + → CaSO4(s) ↓
- Zat-zat yang Mengendap Sebagai Senyawa Sulfat
Ada zat (ion atau unsur) yang mengendap sebagai senyawa sulfat. Untuk itu kita harus sediakan zat pengendap yang dapat membebaskan senyawa sulfat seperti trimetil fosfat. Trimetil fosfat dapat terhidrolisis didalam air membebaskan ion fosfat (PO43- ) yang kemudian akan bereaksi dengan zat yang ingin diendapkan.
Warna Endapan
Banyak senyawa yang mengandung ion logam menghasilkan endapan dengan warna yang khas. Berikut ini adalah warna khas untuk berbagai logam. Namun demikian, banyak dari senyawa ini dapat menghasilkan warna yang sangat berbeda.
| Senyawa | Warna |
| Emas | Oranye |
| Krom | Hijau tua, hijau keruh, oranye, ungu, kuning, coklat |
| Kobalt | Warna merah muda |
| Tembaga | Biru |
| Besi (II) | Hijau |
| Besi (III) | Coklat kemerahan |
| Mangan | Merah muda pucat |
| Nikel | Hijau |
Contoh soal :
Periksalah dengan suatu perhitungan apakah terbentuk endapan Ca(OH)2 jika 10 mL larutan CaCl2 0,2 M di reaksikandengan 10 mL larutan NaOH 0,02 M. (KspCa(OH)2 = 8 x 10-6)
Pembahasan:
Langkah pertama adalah menentukan mol masing masing zat.
n CaCl2 = M × V = 0,2 × 10 = 2 mmol
n NaOH = M × V = 0,02 × 10 = 0,2 mmol
Reaksi yang terjadi adalah:
CaCl2 + 2NaOH → Ca(OH)2 + 2NaCl
Ca(OH)2 adalah zat yang sukar larut yang jika terion menjadi :
Ca(OH)2 → Ca2+ + 2OH–
Jumlah mol ion Ca2+ berasal dari CaCl2-, sedangkan jumlah mol ion OH–berasal dari NaOH, untuk itu kita cari konsentrasinya setelah larutan dicampur.
Vcampuran = 10 + 10 = 20 mL

Contoh soal :
- Dalam suatu larutan terdapat CaCl2 dan BaCl2 masing masing 0,01 M. Larutan ini ditetesi sedikit demi sedikit Na2SO4. Anggaplah volume larutan tidak berubah dengan penambahan Na2SO4 0,01 M tersebut. Ion manakah yang akan diendapkan terlebih dahulu?(Ksp CaSO4 = 9,1 x 10-6 dan Ksp BaSO4 = 1,1 x 10-10)
Pembahasan:
Reaksi yang terjadi adalah :
CaCl2 + Na2SO4 → CaSO4 + 2NaCl
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Garam yang diperkirakan akan mengendap adalah CaSO4 dan BaSO4 (Jika tidak tahu menentukan garam mana yang akan mengendap maka lihat saja data Ksp -nya)
Kita lihat dulu reaksi pertama = Garam CaSO4
Garam ini akan mengion menjadi :
CaSO4 → Ca2+ + SO42-
Konsentrasi ion Ca2+ didapat dari CaCl2 = 0,01 M = 10-2 M
Konsentrasi ion didapat dari Na2SO4 = 0,01 M = 10-2 M
Qc CaSO4 = [Ca2+][SO42-]
= (10-2)( 10-2)
= 10-4
Harga Qc untuk CaSO4 akan sama dengan BaSO4 karena memiliki konsentrasi yang sama yaitu 10-4.
Dari hal ini dapat diambil kesimpulan:
Karena Qc > Ksp CaSO4 dan Ksp BaSO4 ,maka kedua garam akan mengendap
Yang mengendap dahulu adalah yang Ksp nya paling kecil yaitu BaSO4 (ion Ba2+).
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia



