Hukum Perbandingan Berganda (Dalton) – Konsep, Bunyi dan Contoh Soal – John Dalton, seorang guru sekolah dari Inggris yang ahli dalam fisika dan kimia, pada tahun 1803 yang menemukan hukum perbandingan berganda.

Komposisi kimia ditunjukkan oleh rumus kimianya. Dalam senyawa, seperti air, dua unsur bergabung dan masing-masing menyumbangkan sejumlah atom tertentu untuk membentuk suatu senyawa.
Dari dua unsur dapat dibentuk beberapa senyawa dengan perbandingan berbeda-beda. Misalnya, belerang dengan oksigen dapat membentuk senyawa SO2 dan SO3. Dari unsur hidrogen dan oksigen dapat dibentuk senyawa H2O dan H2O2.
Bunyi Hukum
Ketertarikan John Dalton mempelajari dua unsur yang dapat membentuk lebih dari satu senyawa ternyata Menghasilkan suatu kesimpulan yang disebut hukum perbandingan berganda:
’’Bila dua unsur dapat membentuk lebih dari satu senyawa, maka perbandingan massa unsur yang satu, yang bersenyawa dengan unsur lain yang tertentu massanya merupakan bilangan bulat dan sederhana’’.
Sebagai contoh yaitu tembaga dengan oksigen,karbon dengan oksigen, belerang dengan oksigen, dan fosfor dengan klor.
Perbandingan massa kedua unsur tersebut adalah sebagai berikut :
1. Tembaga dan oksigen membentuk dua senyawa tembaga oksida.
| Tembaga oksigen | Tembaga | Oksigen | Tembaga : oksigen |
| I | 88,8% | 11,2% | 1 : 0,126 |
| I | 79,9% | 20,1% | 1 : 0,252 |
2. Karbon dan oksigen dapat membentuk dua senyawa
Karbon + oksigen → Karbon monoksida (I)
Karbon + oksigen → Karbon diosida (II)
| Senyawa | Karbon | Oksigen | Karbon : Oksigen |
| I | 42,8% | 57,2% | 1 : 1,33 |
| II | 27,3% | 72,7% | 1 : 2,67 |
3. Sulfur (belerang) dengan oksigan dapat membentuk dua senyawa
oksigen, yaitu sulfur oksida (I) dan sulfur trioksida (II).
| Senyawa | Belerang | Oksigen | Belerang : Oksigen |
| I | 50% | 50% | 1 : 0,1 |
| II | 40% | 60% | 1 : 1,5 |
Sampai kini hukum ini masih dapat diterima, tetapi perlu dikoreksi mengenai bilangan sederhana. Jika perbandingan itu bilangan sederhana (1, 2, 3, 4, 5) berarti rumus senyawa juga sederhana, seperti H2O, CO2, dan H2SO4. Akan tetapi kini ditemukan senyawa dengan bilangan besar, seperti sukrosa dan asam arakidonat.
Contoh Soal
Karbon dapat bergabung dengan Hidrogen dengan perbandingan 3 : 1 membentuk gas metana. Berapa massa Hidrogen yang diperlukan untuk bereaksi dengan 900 gram C pada metana.
Penyelesaian
Diketahui :
C : H = 3 : 1
Massa C = 900 gram
Dit = massa H = …?
Jawab :
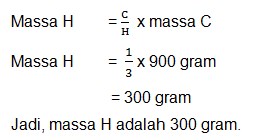
Baca Lebih Lengkap disini : 20+ Soal Hukum Dasar Kimia dan Jawaban [+Pembahasan]
Lihat Juga :




3. Dua senyawa tembaga oksida masing-masing mengandung 20,1% dan 11,2% oksigen.
Tunjukkan bahwa data ini sesuai dengan hukum perbandingan berganda!