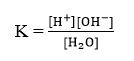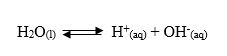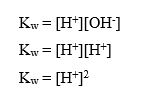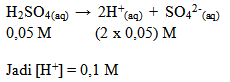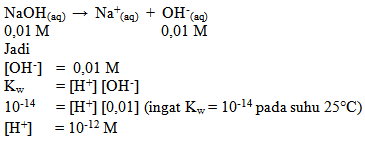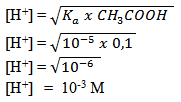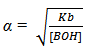Kesetimbangan Ion dalam Larutan Asam Basa – Air yang ada di alam, seperti air laut merupakan campuran berbagai macam larutan garam yang dapat memengaruhi pH. Campuran tersebut juga dapat mempertahankan harga pH, walaupun air sungai yang mengalir ke laut bersifat asam atau basa.
Mengapa hal tersebut dapat terjadi? Selain itu, ada juga garam-garam yang hampir tidak larut dalam air pada pH tertentu, tetapi dapat larut dalam pH yang berbeda.
Baca disini Materi Lengkap : Asam Basa – Pengertian, Teori, Derajat Keasaman (PH) dan Reaksinya
KESETIMBANGAN AIR
Air merupakan elektrolit yang sangat lemah karena sebagian kecil molekul air terionisasi dengan reaksi:
Ionisasi air ini merupakan reaksi kesetimbangan sehingga berlaku hukum kesetimbangan:
Air murni mempunyai konsentrasi yang tetap sehingga hasil kali dari konsentrasi air murni dengan K akan menghasilkan nilai yang tetap.
Oleh karena nilai K[H2O] tetap, tetapan kesetimbangan air dinyatakan sebagai tetapan ionisasi air dan diberi lambang Kw.
Nilai tetapan ionisasi air tetap pada suhu tetap. reaksi ionisasi air merupakan reaksi endoterm sehingga bila suhunya naik, nilai Kw akan semakin besar. Pada suhu 25oC, nilai Kw adalah 10-14. Persamaan reaksi ionisasi air berikut,
menunjukkan bahwa [H+] = [OH–]
Baca Juga : 45+ Soal Asam Basa Pilihan Ganda dan Jawaban serta [+Pembahasan]
PENGARUH ASAM DAN BASA TERHADAP KESETIMBANGAN AIR
Adanya ion H+ yang dihasilkan oleh suatu asam dan ion OH– yang dihasilkan oleh suatu basa dapat mengakibatkan terjadinya pergeseran kesetimbangan pada reaksi kesetimbangan air :
Asam Kuat
Asam kuat merupakan asam yang dianggap terionisasi sempurna dalam larutannya.
Secara umum, apabila di dalam air terdapat asam kuat (HnA) dengan konsentrasi a mol/liter, konsentrasi ion H+ dalam asam tersebut dapat dihitung dengan cara :
maka
dengan a = kemolalan asam
n = jumlah ion H+ yang dihasilkan dari ionisasi asam
Contoh Soal
Hitunglah Konsentrasi ion H+ dalam larutan H2SO4 0,05 M.
jawab :
Baca Juga Soal Lengkap : 45+ Soal Asam Basa Pilihan Ganda dan Jawaban serta [+Pembahasan]
Basa Kuat
Basa kuat sama halnya dengan asam kuat, yaitu basa yang didalam larutannya dianggap terionisasi sempurna.
Secara umum jika didalam air terdapat basa kuat (L(OH)n) dengan konsentrasi b mol/liter, konsentrasi ion OH– dalam basa tersebut dapat dihitung dengan cara :
dengan b = kemolalan basa
n = jumlah ion OH– yang dihasilkan dari ionisasi basa
Hitunglah H+ dan OH– yang terdapat dalam larutan NaOH 0,01 M.
jawab :
Asam Lemah
Asam lemah adalah asam yang didalam larutannya hanya sedikit terionsiasi atau mempunyai derajat ionisasi yang kecil. Reaksi ionisasi pada asam lemah merupakan reaksi kesetimbangan ionisasi, misalnya untuk asam HA :
Tetapan ionisasi pada asam lemah diberi lambang Ka :
Setiap satu molekul HA yang terionisasi akan menghasilkan sebuah ion H+ dan sebuah ion A–. Oleh karena itu, konsentrasi ion H+ yang berasal dari HA akan selalu sama dengan konsentrasi ion A– atau [H+] = [A–] sehingga konsentrasi ion A– dapat disubstitusikan ke dalam persamaan :
Oleh karena itu [H+] = [A–], Maka :
atau
dengan Ka = Ketetapan ionisasi asam
[HA] = Konsentrasi asam
Nilai Ka menggambarkan kekuatan asam. Semakin besar nilai Ka berarti semakin banyak ion H+ yang dihasilkan, atau semakin kuat asam tersebut. Selain nilai Ka besaran lain yang dapat digunakan untuk mengetahui asam adalah derajat ionisasi (α).
Rumus tersebut menunjukkan bahwa jika larutan semakin encer, derajat ionisasinya semakin besar. Demikian juga jika larutan semakin pekat, derajat ionisasinya semakin kecil. Asam sangat pekat bahkan mempunyai derajat ionisasi mendekati nol.
Hitunglah konsentrasi ion H+ di dalam larutan CH3COOH 0,01 M jika tetapan ionisasi (Ka) CH3COOH = 10-5
jawab :
Asam Poliprotik
Asam poliprotik adalah asam yang dalam larutannya dapat melepaskan lebih dari satu ion H+ , misalnya, H2CO3 , H3PO4 , dan H2S.
Nilai tetapan kesetimbangan secara keseluruhan merupakan hasil kali dari Ka pada tahapan reaksi-reaksi kesetimbangan secara keseluruhan.
Basa Lemah
Basa Lemah seperti halnya asam lemah, basa lemah hanya sedikit mengalami ionisasi sehingga reaksi ionisasi basa lemah merupakan reaksi kesetimbangan :
Dengan cara penurunan yang sama, didapatkan rumus untuk menghitung konsentrasi OH– dalam larutan adalah sebagai berikut.
dan derajat ionisasinya dapat ditentukan dengan rumus:
Kb dan α dapat digunakan sebagai ukuran kekuatan basa. semakin besar nilai Kb, semakin kuat basanya dan semakin besar nilai derajat ionisasinya.
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia
Dapatkan Buku Gratis Kimia Kelas 11