Kimia Unsur – Pengertian, Sifat, Pembuatan, Pemisahan dan Kegunaan – Alam semesta ini kaya akan kadungan unsur-unsur kimia. Hingga saat ini, unsur-unsur kimia berjumlah sekitar 114 unsur. Unsur-unsur tersebut dikelompokkan berdasarkan kesamaan sifatnya ke dalam beberapa golongan, yaitu golongan A (golongan utama) dan golongan B (golongan transisi). Selain itu, unsur-unsur kimia dapat dikelompokkan menjadi unsur logam, nonlogam, semilogam, dan gas mulia. Beberapa usur logam dan nonlogam, dalam bentuk unsur maupun senyawa, banyak dimanfaatkan didalam kehidupan sehari-hari. Penggunaan beberapa unsur logam dan nonlogam meningkat dengan berkembang pesatnya industri, baik sebagai alat, bahan dasar, maupun sumber energi.
Unsur-unsur logam umumnya diperoleh sebagai bijih logam dalam batuan. Alam Indonesia sangat kaya akan sumber mineral bijih logam, karena itu perlu penguasaan teknologi untuk mengolahnya menjadi logam yang dibutuhkan.
Unsur Logam yang sudah akrab dengan kehidupan kita sehari-hari diantaranya adalah, besi, tembaga, atau perak. Ternyata unsur natrium pun bersifat logam. Namun, karena tak stabil dalam keadaan unsurnya, ia lebih banyak kita temui dalam bentuk senyawanya.
Keberadaan unsur-unsur kimia di alam sangat melipah. Sumber unsur-
Unsur kimia terdapat di kerak bumi, dasar laut, dan atmosfer, baik dalam bentuk unsur bebas, senyawa ataupun campurannya. Unsur-unsur kimia yang terdapat di alam dalam bentuk unsur bebasnya (tidak bersenyawa dengan unsur lainnya), diantaranya logam platina (Pt), emas (Au), karbon (C), gas nitrogen (N2), oksigen (O2), dan gas-gas mulia. Adapun unsur-unsur lainnya ditemukan dalam bentuk bijih logam. Bijih logam merupakan campuran antara mineral yang mengandung unsur-unsur kimia dan pengotornya. Mineral-mineral tersebut berbentuk senyawa oksida, halida, fosfat, silikat, karbonat, sulfat, dan sulfida. Logam platina (Pt) dan emas (Au) disebut logam mulia. Sumber logam mulia dan mineral-mineral dapat ditemukan di kerak bumi, sedangkan sumber gas oksigen, nitrogen, dan gas mulia (kecuali He) terdapat di lapisan atmosfer.
Simak Juga : Soal Kimia Unsur Pilihan Ganda dan Jawaban
A. Pengertian Unsur Kimia
Unsur kimia adalah suatu spesies atom yang memiliki jumlah proton yang sama dalam inti atomnya (yaitu, nomor atom, atau Z, yang sama). Sebanyak 118 unsur telah diidentifikasi, yang 94 di antaranya terjadi secara alami di bumi. Sedangkan 24 sisanya, merupakan unsur sintetis. Terdapat 80 unsur yang memiliki sekurang-kurangnya satu isotop stabil dan 38 unsur yang merupakan radionuklida yang, seiring berjalannya waktu, meluruh menjadi unsur lain. Besi adalah unsur penyusun bumi paling melimpah (berdasarkan massa), sementara oksigen adalah yang paling melimpah di kerak bumi.
B. Kelimpahan Unsur – Unsur di Alam
Dari 118 unsur yang diketahui, sekitar 90 unsur berada di alam dan sisanya merupakan unsur sintesis (unsur buatan). Sebagian dari unsur tersebut terdapat sebagai unsur bebas, tetapi lebih banyak yang berupa senyawa, sedangkan unsur-unsur gas mulia terdapat sebagai unsur bebas (Petrucci dan Suminar Ahmad, 1987: 96). Sebagian besar logam diperoleh dari deposit tanah, bahan-bahan alam yang mengandung unsur atau senyawa tertentu disebut mineral. Mineral yang mengandung unsur atau senyawa tertentu dengan konsentrasi cukup tinggi dan diolah agar bernilai ekonomis disebut bijih(Brady, 1990: 653). Unsur-unsur yang paling melimpah di kulit bumi adalah oksigen, silikon, dan aluminium.
Sumber komersial dari oksigen dan nitrogen adalah udara. Kelimpahan unsur nitrogen dalam udara 78,09% dan oksigen 20,94%. Sedangkan unsur lainnya kurang dari 1%. Beberapa unsur diperoleh dari air laut. Misalnya, natrium, klorin, magnesium, dan bromin. Konsentrasi unsur terbesar dalam air laut adalah klorida sebesar 18,980 g/kg air laut, kemudian diikuti unsur natrium sebesar 10,556 g/ kg air laut (Sumber: Petrucci dan Suminar Ahmad, 1987: 98).
C. Gas Mulia Dan Halogen
Gas Mulia (Golongan VIIIA)
Gas mulia adalah unsur-unsur golongan VIIIA (18). Disebut mulia karena unsur-unsur ini sangat stabil (sangat sukar bereaksi).

Ada 2 sifat dari gas mulia, yaitu sebagai berikut :
Sifat-sifat Fisis Gas Mulia
| Sifat | He | Ne | Ar | Kr | Xe | Rn |
| Nomor atom | 2 | 10 | 18 | 36 | 54 | 86 |
| Elektron Valensi | 2 | 8 | 8 | 8 | 8 | 8 |
| Jari-jari atom (A) | 0,50 | 0,65 | 0,95 | 1,10 | 1,30 | 1,45 |
| Titik leleh (oC) | -272,2 | -248,6 | -189,4 | -157,2 | -111,8 | -71 |
| Titik didih (oC) | -268,9 | -246,0 | -185,9 | -153,4 | -108,1 | -62 |
| Energi Pengionan (kJ mol -1) | 2640 | 2080 | 1520 | 1350 | 1170 | 1040 |
| Afinitas elektron (kJ mol-1) | 21 | 29 | 35 | 39 | 41 | 41 |
| Densitas (g L-1) | 0.178 | 0,900 | 1,78 | 3,73 | 5,89 | 9,73 |
Seperti tampak pada Tabel, gas mulia mempunyai titik leleh serta titik didih yang sangat rendah. Titik didih helium mendekati nol absolut (0 K). Titik didih gas mulia hanya beberapa derajat di atas titik lelehnya. Rendahnya titik didih gas mulia dapat diterangkan sebagai berikut. Seperti telah diketahui, gas mulia terdapat molekul monoatomik.
Gaya tarik-menarik antarmolekulnya hanyalah gaya London (gaya dispersi) yang lemah. Oleh karena itu, gas mulia hanya akan mencair atau menjadi padat jika energi molekul-molekulnya menjadi sangat dilemahkan, yaitu pada suhu yang sangat rendah. Dari atas ke bawah, seiring dengan bertambahnya massa atom relatif, gaya dispersi semakin besar dan titik leleh serta titik didihnya juga meningkat.
Sifat-Sifat Kimia Gas Mulia
Dunia kimia seperti terguncang ketika pada tahun 1962, Bartlett berhasil membuat senyawa stabil dari xenon, yaitu XePtF6. Penemuan itu telah mendobrak kegaiban gas mulia. Tidak lama kemudian, ahli riset lainnya dapat membuat berbagai senyawa dari xenon, radon, kripton. Radon ternyata dapat bereaksi spontan dengan fluorin, sedangkan xenon memerlukan pemanasan atau penyinaran untuk memulai reaksi. Kripton lebih sukar, hanya bereaksi dengan fluorin jika disinari atau jika diberi loncatan muatan listrik. Sementara helium, neon, dan argon, ternyata lebih sukar lagi bereaksi dan belum berhasil dibuat suatu senyawa dari ketiga unsur itu.
Kereaktifan gas mulia bertambah besar sesuai dengan pertambahan jari-jari atomnya, yaitu dari atas ke bawah. Pertambahan jari-jari atom mengakibatkan daya tarik inti terhadap elektron kulit luar berkurang, sehingga elektronnya semakin mudah ditarik oleh atom lain. Walaupun senyawa gas mulia telah berhasil dibuat, namun tetap harus diakui bahwa unsur gas mulia lebih stabil dari semua golongan lainnya. Unsur gas mulia hanya dapat berikatan dengan unsur yang sangat elektronegatif, seperti fluorin dan oksigen.
Kegunaan dalam Kehidupan
| Gas Mulia | Kegunaan |
| He | Pengisi balon udara |
| Campuran He/O2, di samping N2/O2, untuk pernapasan penyelam | |
| Pelarut untuk anestesi gas | |
| Campuran He/O2 untuk pernapasan pasien | |
| Transfer panas sedang untuk reaktor nuklir | |
| Atmosfer inert untuk pengelasan logam | |
| He cair digunakan untuk menjaga suhu rendah dalam penelitian | |
| (kriogenik) | |
| Pendingin untuk superkonduktor dalam scanner | |
| Pendorong bahan bakar cair pada roket | |
| Untuk mengangkat peralatan-peralatan ke atmosfer yang lebih tinggi | |
| untuk mengukur kondisi atmosfer | |
| Ne | Lampu neon |
| Cahaya fluoresensi | |
| TV tabung | |
| Laser neon | |
| Ar | Atmosfer inert untuk pengelasan |
| Pengisi bola lampu | |
| Kr | Pemandu pesawat tinggal landas |
| Xe | Campuran Xe dan Kr dengan intensitas tinggi digunakan untuk |
| pencahayaan dalam lampu fotografi | |
| Rn | Terapi kanker secara radiokimia |
Simak Juga : Soal Gas Mulia Pilihan Ganda dan Jawaban
Halogen (Golongan VIIA)
Unsur-unsur golongan VIIA disebut halogen. Nama itu berasal dari bahasa Yunani yang berarti “pembentuk garam”. Dinamai demikian karena unsur-unsur tersebut dapat bereaksi dengan logam membentuk garam.
Unsur-unsur halogen mempunyai 7 elektron valensi pada subkulit ns2 np5. Konfigurasi elektron yang demikian membuat unsur-unsur halogen bersifat sangat reaktif. Halogen cenderung menyerap satu elektron membentuk ion bermuatan negatif satu. Ada 2 sifat dari gas mulia, yaitu sebagai berikut :
Sifat-Sifat Fisis Halogen
| Sifat-sifat | F | Cl | Br | I | At |
| Wujud (25⁰C) | Gas | Gas | Cair | Padat | Padat |
| Warna | Kuning muda | Kuning-hijau | Merah-cokelat | Violet(g), hitam (s) | ― |
| Jari-jari atom (Å) | 0,72 | 1,00 | 1,14 | 1,33 | 1,40 |
| Jari-jari anion X-(Å) | 1,19 | 1,67 | 1,82 | 2,06 | ― |
| Konfigurasi e– valensi | 2s2 2p5 | 3s2 3p5 | 4s2 4p5 | 5s2 5p5 | 6s2 6p5 |
| Energi ionisasi pertama (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 890 |
| Afinitas elektron (kJ/mol) | -328 | -349 | -325 | -249 | |
| Keelektronegatifan | 4,0 | 3,0 | 2,8 | 2,5 | 2,1 |
| Titik leleh (⁰C, 1 atm) | -220 | -101 | -7,1 | 114 | ― |
| Potensial reduksi standar (volt) X2→2Xˉ | 2,87 | 1,36 | 1,06 | 0,54 | ― |
| Titik didih (⁰C, 1 atm) | -188 | -35 | 59 | 184 | ― |
| Energi ikatan X―X (kJ/mol) | 155 | 242 | 193 | 151 | ― |
| Kerapatan (g/cm3) | 1,11 | 1,56 | 3,212 | 4,93 | ― |
Dari tabel tampak bahwa titik didih dan titik leleh naik seiring dengan bertambahnya nomor atom. Hal ini karena fakta menunjukkan bahwa molekul-molekul yang lebih besar mempunyai gaya tarik-menarik Van der Waals yang lebih besar daripada yang dimiliki molekul-molekul yang lebih kecil. Kecuali gas mulia, halogen mempunyai energi ionisasi dan elektro-negatifitas yang paling tinggi dari golongan unsur manapun. Dari unsur golongan VII A, fluorlah yang paling erat mengikat elektron-elektronnya, dan iod yang paling lemah. Kecenderungan ini bisa dikaitkan dengan ukuran atom halogen (Keenan, dkk, 1992: 228).
Sifat-Sifat Kimia Halogen
Ada suatu penurunan yang teratur dalam keaktifan kimia dari fluor sampai iod, sebagaimana ditunjukkan oleh kecenderungan dalam kekuatan mengoksidasinya. Molekul fluor yang beratom dua (diatom) F2 merupakan zat pengoksidasi yang lebih kuat daripada unsur lain yang manapun dalam keadaan normalnya.
Baik fluor maupun klor membantu reaksi pembakaran dengan cara yang sama seperti oksigen. Hidrogen dan logam-logam aktif terbakar dalam salah satu gas tersebut dengan membebaskan panas dan cahaya. Reaktivitas fluor yang lebih besar dibanding klor terungkap oleh fakta bahwa bahan-bahan yang biasa termasuk kayu dan beberapa plastik akan menyala dalam atmosfer fluor.
Keempat unsur halogen tersebut semuanya sangat merangsang sekali terhadap hidung dan tenggorokan. Brom, suatu cairan yang merah tua, pada suhu kamar mempunyai tekanan uap yang tinggi. Brom cair merupakan salah satu reagen kimia yang paling berbahaya karena efek uap tersebut terhadap mata dan saluran hidung. Klor dan fluor harus digunakan hanya dalam kamar asam dan dalam ruangan dengan pertukaran udara (ventilasi) yang baik. Beberapa hisapan klor pada 1.000 ppm bersama napas kita akan mematikan. Semua halogen harus disimpan jauh dari kontak dengan zat-zat yang dapat dioksidasi (Keenan, 1992: 229).
Reaksi-reaksi Halogen
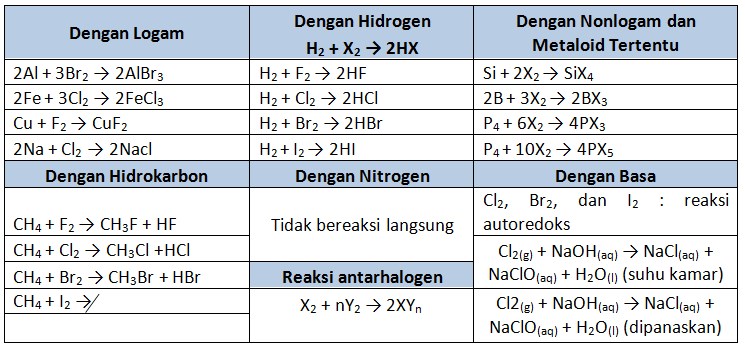
Reaksi ion-ion Halida dengan H2SO4 pekat
Asam sulfat memiliki sifat sebagai oksidator maupun sebagai asam. Semua senyawa halida dapat bereaksi dengan H2SO4.
- Ion fluorida dan ion klorida bereaksi dengan H2SO4 pekat berturut-turut menghasilkan asam fluorida dan asam klorida.
- Ion bromide dan ion iodide bereaksi dengan H2SO4 pekat berturut-turut tidak menghasilkan asam bromide dan asam iodida, tetapi menghasilkan belerang dioksida (SO2) dan asam sulfide (H2S)
| Xˉ | Reaksi dengan H2SO4 |
| Fˉ | NaF(aq) + H2SO4(aq) → NaHSO4(aq) + HF(aq) |
| 2NaF(aq) + H2SO4(aq) → Na2SO4(aq) + 2HF(aq) | |
| Clˉ | NaCl(aq) + H2SO4(aq) → NaHSO4(aq) + HCl(aq) |
| 2NaCl(aq) + H2SO4(aq) → Na2SO4(aq) + 2HCl(aq) | |
| Brˉ | 2NaBr(aq) + 2H2SO4(aq) → Na2SO4(aq) + SO2(g) + Br2(l) + 2H2O(l) |
| Iˉ | 8NaI(aq) + 5H2SO4(aq) → 4Na2SO4(aq) + H2S(g) + 4I2(s) + 4H2O(l) |
Reaksi dengan H3O4 Pekat
Asam fosfat pekat adalah asam lemah dan oksidator lemah yang dapat bereaksi dengan semua garam halida menghasilkan garam-garam halide. Reaksi ini banyak diterapkan dalam pembuatan asam-asam halida di laboratorium dengan persamaan reaksi umum : 3Xˉ + H3PO4 → PO43ˉ + 3HX
| Xˉ | Reaksi dengan H3PO4 |
| Fˉ | 3NaF(aq) + H3PO4(aq) → Na3PO4(aq) + 3HF(aq) |
| Clˉ | 3NaCl(aq) + H3PO4(aq) → Na3PO4(aq) + 3HCl(aq) |
| Brˉ | 3NaBr(aq) + H3PO4(aq) → Na3PO4(aq) + 3HBr(aq) |
| Iˉ | 3NaI(aq) + H3PO4(aq) → Na3PO4(aq) + 3HI(aq) |
Penggunaan Halogen dalam Kehidupan
Penggunaan fluor
- Untuk membuat pendingin dan deterjen.
- Memproduksi uranium heksafluorida dan senyawa fluor lainnya.
- Untuk bahan bakar roket.
- Ion fluorida digunakan dalam pasta gigi untuk mencegah gigi berlubang.
- Senyawa terfluorinasi dapat digunakan untuk membuat plastik dan juga untuk sketsa kaca.
- Senyawa terfluorinasi juga untuk menandai bola kaca tipis untuk dukir.
Penggunaan klor
- Sebagai pemutih kertas dan kain.
- Penggunaan dalam air minum dan kolam renang karena dapat membunuh bakteri berbahaya.
- Untuk produksi insektisida, pelarut, pewarna makanan, plastik, pewarna tekstil, produk minyak bumi, produk kertas, dan lain-lain.
Penggunaan brom
- Sebagai decomposer yang baik karena brom memiliki afinitas terhadap hidorgen.
- Untuk mensterilkan air karena dapat membunuh bakteri.
- Digunakan dalam pemadam api, pewarna, dan obat-obatan.
Penggunaan iod
- Digunakan dalam pengobatan, fotografi, dan pewarna.
- Untuk mengidentifikasi amilum.
- Sebagai pengontras X-ray dan untuk injeksi intravena.
Penggunaan astatine
Astatin berupa padatan pada suhu kamar. Salah satu karakteristik khusus dari astatine adalah tidak ditemukan di alam sama sekali. Astatin dihasilkan oleh bombardier bismut dengan partikel alpha. Pemanfaatan astatin belum ditemukan.
Simak Juga : Soal Halogen Pilihan Ganda dan Jawaban
D. Logam Alkali dan Alkali Tanah
Logam Alkali (Golongan IA)
Unsur logam alkali (IA) terdiri dari litium, natrium, kalium, rubidium, sesium, dan fransium. Unsur ini mempunyai energi ionisasi paling kecil karena mempunyai konfigurasi elektron ns1. Oleh karena itu, unsur logam alkali mudah melepaskan elektron dan merupakan reduktor yang paling kuat. Unsur alkali merupakan logam lunak, berwarna putih mengkilap, konduktor yang baik, dan mempunyai titik leleh yang rendah, serta ditemukan dalam bentuk garamnya (Mc. Murry dan Fay, 2000: 215).

Sifat-Sifat fisik Logam Alkali
| Sifat-sifat | Li | Na | K | Rb | Cs | Fr |
| Elektron terluar | 2s1 | 3s1 | 4s1 | 5s1 | 6s1 | 7s1 |
| Titik leleh (⁰C) | 186 | 97,8 | 63,6 | 38,9 | 28,5 | 27 |
| Titik didih (⁰C) | 1347 | 904 | 774 | 688 | 678 | 677 |
| Kerapatan (g/cm3) | 0,534 | 0,971 | 0,862 | 1,53 | 1,87 | – |
| Jari-jari atom (Å) | 1,52 | 1,86 | 2,27 | 2,48 | 2,65 | – |
| Keelektronegatifan | 1,0 | 0,9 | 0,9 | 0,9 | 0,8 | 0,8 |
| E⁰red(volt) : M+(aq)+eˉ → M(s) | -3,05 | -2,71 | -2,93 | -2,93 | -2,92 | – |
| Energi ionisasi (kJ/mol) : M(g) → M+(g) + eˉ | 520 | 496 | 419 | 403 | 377 | – |
| M+(g) → M2+(g) + eˉ | 7298 | 4562 | 3051 | 2632 | 2420 | – |
| ∆H⁰hidrasi(kJ/mol) : M(g) + xH2O→ M+(aq) | -544 | -435 | -351 | -293 | -264 | – |
Sifat Kimia Logam Akali
- Logam alkali juga bersifat korosif. Cesium (tampak seperti emas) meleleh di tangan dan dapat terjebak dalam plastik karena korosif.
- Titik leleh dan titik didih logam alkali relatif rendah karena lemahnya ikatan logam. Setiap atom hanya dapat member satu electron untuk membentuk ikatan logam.
- Logam-logam alkali menjadi penghantar listrik dan panas yang baik, karena elektron valensinya begitu mudah berpindah.
- Atom-atom logam alkali terionisasi jika disinari dengan cahaya berenergi rendah (efek fotolistrik). Efek ini makin besar dengan bertambahnya ukuran atom. Itulah sebabnya, cesium digunakan dalam sel fotolistrik.
- Logam-logam alkali memiliki energi ionisasi yang rendah karena elektron valensi atom-atom logam alkali sangat mudah dilepaskan.
- Dalam senyawa-senyawanya, semua logam alkali memiliki bilangan oksidasi +1.
- Garam-garam logam alkali dengan anion-anion yang kecil sangat mudah larut dalam air, tetapi garam-garam dengan anion yang besar dan kompleks, seperti silikat dan aluminosilikat, sangat tidak larut dalam air.
- Semakin ke bawah dalam golongan, reaktivitas makin besar.
Reaksi-reaksi Logam Akali
| Reaksi | Keterangan |
| 4M + O2 →2M2O | O2 terbatas |
| 4Li + O2 → 2Li2O | O2 berlebih |
| 2Na + O2 →Na2O2 | Produk : natirium peroksida |
| M + O2 → MO2 | Superoksida (M = K, Rb, Cs; O2 berlebih) |
| K + O2 → KO2 | contoh reaksi |
| 2M + H2 → 2MH | M : lelehan logam |
| 2Na + H2 → 2NaH | contoh reaksi |
| 6Li + N2 →2Li3N | Pada suhu tinggi |
| 2M + X2 → 2MX | X = halogen (VIIA), berlangsung hebat |
| 2Na + Cl2 → 2NaCl | contoh reaksi |
| 2M + S → M2S | Alkali juga berlangsung hebat dengan Se dan Te dari golongan VIA |
| 2K + S → K2S | contoh reaksi |
| 12M + P4 → 4M3P | |
| 12K + P4 → 4K3P | contoh reaksi |
| 2M + 2H2O → 2MOH + H2 | Na, K, Rb, dan Cs bereaksi eksplosif |
| 2Na + 2H2O → 2NaOH + H2 | contoh reaksi |
| 2M + NH3 → 2MNH2 + H2 | Dengan NH3(l) dengan adanya katalis, dengan NH3(g) pada suhu tinggi |
| 2K + NH3 → 2KNH2 + H2 | contoh reaksi |
| M + asam → Garam + H2 | Semua alkali bereaksi kuat |
| 2Na + 2HCl→ 2NaCl + H2 | contoh reaksi |
Kegunaan Logam Akali dalam Kehidupan
Litium dan seyawanya
- Digunakan sebagai media transfer panas dalam percobaan reaktor nuklir, karena Li memiliki kapasitas panas yang tinggi.
- Paduan litium-aluminium yang sangat ringan digunakan dalam konstruksi pesawat terbang.
- Digunakan dalam sel kering yang ringan dan baterai karena memiliki masa pakai yang lama, bahkan pada suhu yang sangat tinggi sekalipun.
- LiCl dan LiBr sangat higroskopis dan digunakan dalam proses-proses pengeringan di industri dan pengatur kondisi udara (air conditioning)
Natrium dan senyawanya
- Digunakan sebagai pereduksi dalam pembuatan bahan obat-obatan dan penyelup dalam metalurgi logam seperti titanium dan zirkonium.
- Logam Na menghasilkan cahaya kuning yang terang, sehingga digunakan sebagai lampu penerangan jalan raya.
- Natrium banyak dijumpai dalam bentuk senyawa, seperti NaOH (soda kaustik), Na2CO3 (soda abu), Na2CO3.10H2O (soda cuci), dan NaHCO3 (soda kue atau soda bikarbonat).
- NaCl (garam meja) sebagai sumber senyawa-senyawa Na dan Cl yang lain.
- NaNO3 (sendawa Chili) sebagai bahan pupuk. Na2SO4 sebagai bahan untuk produksi HCl NaH digunakan untuk sintesis NaBH4 sebagai bahan untuk recovery perak dan merkuri dari air limbah.
- NaOH digunakan dalam industri rayon, cairan pembersih, sabun, kertas, tekstil, dan polimer.
Logam alkali yang lain
- KNO3 dikenal sebagai sendawa (saltpeter), digunakan sebagai pupuk kalium dan nitrogen.
- Kalium-40 digunakan dalam peluruhan radioaktif kalium-argon untuk mengetahui umur benda-benda kuno.
- Pada penanganan pernapasan darurat, KO2 bereaksi dengan H2O dan CO2 dalam udara pernapasan membentuk O2.
- Logam rubidium, cesium, dan fransium saat ini masih sangat jarang digunakan.
- Cesium digunakan dalam beberapa sel fotolistrik.
Alkali Tanah (Golongan IIA)
Unsur logam alkali tanah (IIA) ini terdiri dari Be, Mg, Ca, Sr, Ba, dan Ra. Golongan ini mempunyai sifat-sifat yang mirip dengan golongan IA. Perbedaannya adalah bahwa golongan IIA ini mempunyai konfigurasi elektron ns2 dan merupakan reduktor yang kuat. Meskipun lebih keras dari golongan, tetapi golongan IIA ini tetap relatif lunak, perak mengkilat, dan mempunyai titik leleh dan kerapatan lebih tinggi (Mc. Murry dan Fay, 2000: 220).
Sifat-Sifat Fisis Alkali Tanah
Unsur-unsur logam alkali tanah agak lebih keras, kekerasannya berkisar dari barium yang kira-kira sama keras dengan timbal, sampai berilium yang cukup keras untuk menggores kebanyakan logam lainnya. Golongan ini mempunyai struktur elektron yang sederhana, unsur-unsur logam alkali tanah mempunyai 2 elektron yang relatif mudah dilepaskan. Selain energi ionisasi yang relatif rendah, keelektronegatifan rata-rata golongan ini juga rendah dikarenakan ukuran atomnya dan jarak yang relatif besar antara elektron terluar dengan inti (Keenan, dkk, 1992: 152-153).
| Sifat-sifat | Be | Mg | Ca | Sr | Ba | Ra |
| Elektron terluar | 2s2 | 3s2 | 4s2 | 5s2 | 6s2 | 7s2 |
| Titik leleh (⁰C) | 1283 | 689 | 839 | 770 | 725 | 700 |
| Titik didih (⁰C) | 2484 | 1105 | 1484 | 1384 | 1640 | 1140 |
| Kerapatan (g/cm3) | 1,85 | 1,74 | 1,55 | 2,60 | 3,51 | 5 |
| Jari-jari atom (Å) | 1,12 | 1,60 | 1,97 | 2,15 | 2,22 | 2,20 |
| Jari-jari ion, M2+ (Å) | 0,59 | 0,85 | 1,14 | 1,32 | 1,49 | – |
| Keelektronegatifan | 1,5 | 1,2 | 1,0 | 1,0 | 1,0 | 1,0 |
| E⁰red(volt) : M+(aq)+eˉ → M(s) | -1,85 | -2,37 | -2,87 | -2,89 | -2,90 | -2,92 |
| Energi ionisasi (kJ/mol) : M(g) → M+(g) + eˉ | 899 | 738 | 599 | 550 | 503 | 509 |
| M+(g) → M2+(g) + eˉ | 1757 | 1451 | 1145 | 1064 | 965 | -979 |
| ∆H⁰hidrasi(kJ/mol) : M(g) + xH2O→ M+(aq) | – | -1925 | -1650 | -1485 | -1276 | – |
Sifat-Sifat Kimia Alkali tanah
- Sifat logam unsur alkali tanah bertambah dengan bertambahnya nomor atom
- Semua logam alkali tanah teroksidasi di tanah membentuk senyawa oksida, kecuali Be.
- Oksida alkali tanah, kecuali BeO, bersifat basa karena bereaksi dengan air membentuk senyawa hidoksida
- Berilium hidroksida, Be(OH)2, tidak terlalu larut dalam air dan bersifat amfoter. Selain itu, ion Be2+ bereaksi dengan larutan basa kuat membentuk endapan Be(OH)2. Jika basa kuatnya berlebih, endapan Be(OH)2 larut membentuk ion kompleks [Be(OH)4]2-.
- Magnesium hidroksida hanya sedikit larut dalam air. Ca(OH)2, Sr(OH)2, dan Ba(OH)2 adalah basa kuat.
- Makin besar nomor atom, makin reaktif logam alkali.
Reaksi-reaksi Alkali Tanah
| Reaksi dengan Oksigen, O2 | Reaksi dengan Air | Reaksi dengan Asam |
| M(s) + O2(g) → MO (s) | M + 2H2O → M(OH)2 + H2 | Be(s) + HCl(aq) → BeCl2(aq) + H2(g) |
| (M=Be, Mg, Ca, Sr, Ba, Ra) | (M=Mg, Ca, Sr, Ba) | Be(s) + H2SO4(aq) → BeSO4(aq) + H2(g) |
| Berilium tidak bereaksi dengan air murni, walaupun | Ba(s) + HCl(aq) → BaCl2(aq) + H2(g) | |
| dipanaskan. Mg bereaksi dengan air panas | Ba(s) + H2SO4(aq) → BaSO4(s) + H2(g) |
Persamaan reaksi pembentukan senyawa oksida, hidrida, dan nitrida logam IA dan IIA
| Senyawa | Logam IA | Logam IIA |
| Oksida | 4M + O2 → 2M2O | 2M + O2 → 2MO |
| Hidrida | 2M + H2 → 2MH | M + H2 → MH2 |
Air Sadah
Air sadah (hard water) adalah air yang sulit digunakan untuk mencuci karena mengandung ion-ion Ca2+ dan Mg2+ yang berlebih. Ion-ion ini mengendapkan sabun atau deterjen sehingga daya cuci sabun atau deterjen menurun bahkan hilang.
Sabun/deterjen + Ca2+/Mg2+(aq) → Ca(sabun/deterjen)2(s)
Contoh :
Sabun stearat + kalsium hydrogen karbonat → kalsium stearat + natrium hydrogen karbonat
2C17H35COONa(s) + Ca(HCO3)2(aq) → Ca(C17H35COO)2(S) + 2NaHCO3(aq)
Akibatnya, sabun atau deterjen dalam air sadah sulit berbuih. Tingkat kesadahan air bergantung pada konsentrasi Ca2+ dan atau Mg2+.
| Tingkat Kesadahan | Konsentrasi Mg2+ dan Ca2+ (gpg)* |
| Lunak | Kurang dari 1,0 |
| Sedikit sadah | 1,0-3,5 |
| Setengah sadah | 3,5-7,0 |
| Sadah | 7,0-10,5 |
| Sangat sadah | Lebih dari 10,5 |
Kegunaan Alkali Tanah dalam Kehidupan
| Logam | Sifat | Kegunaan |
| Berilium (Be) | Senyawa berilium sangat toksis | Karena jarang, berilium hanya memiliki sedikit penggunaan. Berilium terutama terdapat sebagai beril, Be3Al2Si6O18, berwarna hijau. Karena dapat ditembus oleh sinar-X,maka jendela lubang sinar tabung sinar-X dibuat dari Be. |
| Magnesium (Mg) | Logam Mg dapat terbakar di udara dengan pancaran cahaya putih yang terang. | Mg banyak digunakan dalam pencahayaan fotografi dan sebagai bahan kembang api. |
| Kalsium (Ca) | Mudah bereaksi dengan oksigen dan air membentuk senyawa oksida dan hidroksida. | Sebagai zat pereduksi dalam metalurgi uranium, thorium, dan logam-logam yang lain. |
| Reudktor kuat. | Sebagai perangkap untuk menghilangkan pengotor seperti oksigen dan belerang dalam lelehan logam dan untuk menghilangkan gas-gas yang tertinggal dalam tabung hampa udara. | |
| Kalsium merupakan komponen dalam banyak logam paduan. | ||
| Bahan baku pembuatan kapur tohor dan semen untuk bahan-bahan bangunan. | ||
| Stronsium (Sr) | Mudah bereaksi dengan oksigen dan air membentuk senyawa oksidadan hidroksida, dengan reaktivitas yang lebih tinggi daripada kalsium. | Garan stronsium digunakan sebagai kembang api dan obor yang menunjukkan cahaya merah stronsium yang khas dalam nyala. |
| Reduktor kuat. | Logam stronsium sendiri tidak banyak digunakan. Stronsium klorida banyak digunakan dalam pasta gigi untuk orang-orang yang bergigi sensitif. | |
| Barium (Ba) | Semua garam barium terlarut bersifat toksik | Barium merupakan unsur paduan yang digunakan untuk busi karena mudahnya melepaskan elektron ketika dipanaskan. |
| Barium digunakan sebagai zat pengisap gas untuk tabung hampa. | ||
| Lempung barium sulfat halus, BaSO4, digunakan untuk melapisi alat saluran usus dalam penyiapan fotografi sinar-X karena barium sulfat dapat menyerap sinar-X dengan baik. |
Simak Juga : 90+ Soal Alkali dan Alkali Tanah Pilihan Ganda dan Jawaban [+Pembahasan]
E. Unsur – Unsur Periode Ketiga
Natrium
Natrium merupakan unsur alkali dengan daya reduksi paling rendah, dengan sumber utamanya adalah halit (umumnya dalam bentuk NaCl). Pembuatan natrium dapat dilakukan dengan proses Downs, yaitu elektrolisis lelehan NaCl. Air asin yang mengandung NaCl diuapkan sampai kering kemudian padatan yang terbentuk dihancurkan untuk kemudian dilelehkan. Sedangkan untuk me-ngurangi biaya pemanasan, NaCl (titik lebur 801 °C) dicampur dengan 1½ bagian CaCl2 untuk menurunkan suhu lebur hingga 580 °C (Martin S. Silberberg, 2000: 971).
Na dulunya banyak digunakan untuk pembuatan TEL (Tetra Ethyl Lead), yaitu untuk menaikkan bilangan oktan bahan bakar, tetapi sekarang tidak lagi karena mengandung racun yang berbahaya bagi lingkungan. Na juga digunakan untuk pengisi lampu penerangan di jalan maupun di kendaraan. Hal ini dikarenakan emisi warna kuningnya yang mampu menembus kabut dan dapat digunakan juga sebagai cairan pendingin pada reaktor atom (Sri Lestari, 2004: 23).
Magnesium
Magnesium adalah unsur yang sangat melimpah di permukaan bumi, tetapi tidak mudah membuatnya dalam bentuk unsur. Sumber ko-mersial utama magnesium adalah air laut (0,13% kadar Mg), dan dapat ditemukan pada dolomit (CaMg(CO3)2) dan karnalit (KCl.MgCl2.6H2O)(Oxtoby, Gillis, Nachtrieb; Erlangga, 2003: 214).
Kegunaan magnesium, antara lain :
- Pencegah korosi pipa besi di tanah dan dinding kapal laut.
- Mg(OH)2, dapat digunakan sebagai obat maag karena dapat menetralkan kelebihan asam lambung (HCl) dan juga sebagai bahan pasta gigi.
- MgSO4, dikenal dengan nama garam inggris, dapat digunakan sebagai obat pencahar (laktasif usus).
- Campuran logam magnesium (10%) dan aluminium (90%) atau yang sering disebut magnalium dapat digunakan sebagai bahan konstruksi pesawat terbang karena perpaduan ini kuat dan ringan, rudal, dan bak truk.
- Magnesium dipakai untuk membuat kembang api dan lampu penerangan pada fotografi (blitz).
- MgO, dapat digunakan sebagai bata tahan panas/api untuk melapisi tanur dan tempat pembakaran semen.
- Campuran 0,5% Mg, 95% Al, 4% Cu, dan 0,5% Mn atau yang dikenal dengan nama duralumindigunakan untuk konstruksi mobil.
Aluminium
Aluminium ialah unsur melimpah ketiga terbanyak dalam kerak bumi (sesudah oksigen dan silikon), mencapai 8,2% dari massa total. Bijih yang paling penting untuk produksi alu-minium adalah bauksit, yaitu aluminium oksida terhidrasi yang mengandung 50 – 60% Al2O3, 1 – 20% Fe2O3, 1 – 10% silika, sedikit logam transisi, dan sisanya air. Sumber bauksit di Indo-nesia di Bukit Asam (Oxtoby, Gillis, Nachtrieb,2003: 212).
Aluminium diperoleh dengan menggunakan proses Hall-Heroult, sesuai dengan nama penemunya Charles M. Hall(AS) dan Paul Heroult (Perancis) pada tahun 1886.
Fosforus
Sumber utama dari fosfor adalah batuan fosfat yang dikenal dengan nama apatit, Ca9(PO4)6.CaF6.
Ada beberapa jenis fosfor, yaitu :
- Fosfor putih, dengan tetrahedral sebagai bentuk molekulnya, lunak, sangat reaktif, dan beracun. Fosfor jenis ini sering disebut sebagai fosfor kuning karena kadang-kadang berwarna kekuningan.
- Fosfor merah, bentuk molekulnya belum dapat dipastikan, kurang reaktif, dan tidak beracun.
- Fosfor hitam (mirip grafit), diperoleh dengan memanaskan fosfor putih di bawah tekanan pada suhu 550 °C.
Belerang
Belerang terdapat di muka bumi dalam bentuk bebas maupun senyawa. Belerang padat mempunyai dua bentuk alotropi, yaitu belerang rombik dan belerang monoklinik. Belerang yang biasa kita lihat adalah belerang rombik, dengan warna kuning, belerang ini stabil di bawah suhu 95,5 °C. Bila lebih dari suhu 95,5 °C, belerang rombik akan berubah menjadi belerang monoklinik yang akan mencair pada suhu 113 °C. Biasanya belerang dijumpai dalam bentuk mineral sulfida dan sulfat, hidrogen sulfida, maupun senyawa belerang organik.
Belerang dapat diperoleh dengan cara ekstraksi melalui proses Frasch. Belerang yang ada di bawah tanah dicairkan dengan mengalirkan air super panas (campuran antara air dan uap air dengan tekanan sekitar 16 atm dan suhu sekitar 160 °C) melalui pipa bagian luar dari suatu susunan tiga pipa konsentrik. Belerang cair kemudian dipaksa keluar dengan memompakan udara panas (dengan tekanan sekitar 20 – 25 atm). Setelah itu belerang dibiarkan membeku. Belerang yang diperoleh dengan cara ini mempunyai kemurnian sampai 99,6%, hal ini disebabkan karena belerang tidak larut dalam air.
Kegunaan belerang yang utama adalah untuk membuat asam sulfat, vulkanisasi karet, dan membasmi penyakit tanaman. Belerang juga digunakan untuk membuat CS2 dan senyawa belerang lainnya.
Simak Juga : Soal Unsur Periode 3 Pilihan Ganda dan Jawaban
F. Unsur – Unsur Transisi Periode Keempat
Pada sistem periodik unsur, yang termasuk dalam golongan transisi adalah unsur-unsur golongan B, dimulai dari IB – VIIB dan VIII. Sesuai dengan pengisian elektron pada subkulitnya, unsur ini termasuk unsur blok d, yaitu unsur-unsur dengan elektron valensi yang terletak pada subkulit d dalam konfigurasi elektronnya.
Pada bagian ini unsur-unsur transisi yang akan dibahas adalah unsur transisi pada periode 4, yang terdiri dari skandium (Sc), titanium (Ti), vanadium (V), krom (Cr), mangan (Mn), besi (Fe), kobalt (Co), nikel (Ni), tembaga (Cu), dan seng (Zn).
Sifat Logam
Semua unsur transisi adalah logam, yang bersifat lunak, mengkilap, dan penghantar listrik dan panas yang baik. Perak merupakan unsur transisi yang mempunyai konduktivitas listrik paling tinggi pada suhu kamar dan tembaga di tempat kedua. Dibandingkan dengan golongan IA dan IIA, unsur logam transisi lebih keras, punya titik leleh, titik didih, dan kerapatan lebih tinggi. Hal ini disebabkan karena unsur transisi berbagi elektron pada kulit d dan s, sehingga ikatannya semakin kuat (Mc. Murry dan Fay, 2000: 867).
Bilangan Oksidasi
Tidak seperti golongan IA dan IIA yang hanya mempunyai bilangan oksidasi +1 dan +2, unsur-unsur logam transisi mempunyai beberapa bilangan oksidasi. Seperti vanadium yang punya bilangan oksidasi +2, +3, dan +4 (Keenan, dkk, 1992: 167).
Sifat Kemagnetan
Setiap atom dan molekul mempunyai sifat magnetik, yaitu para-magnetik, di mana atom, molekul, atau ion sedikit dapat ditarik oleh medan magnet karena ada elektron yang tidak berpasangan pada orbitalnya dandiamagnetik, di mana atom, molekul, atau ion dapat ditolak oleh medan magnet karena seluruh elektron pada orbitnya berpasangan.
Sedangkan pada umumnya unsur-unsur transisi bersifat paramagnetik karena mempunyai elektron yang tidak berpasangan pada orbital-orbital d-nya. Sifat paramagnetik ini akan semakin kuat jika jumlah elektron yang tidak berpasangan pada orbitalnya semakin banyak. Logam Sc, Ti, V, Cr, dan Mn bersifat paramagnetik, sedangkan Cu dan Zn bersifat diamagnetik. Untuk Fe, Co, dan Ni bersifat feromagnetik, yaitu kondisi yang sama dengan paramagnetik hanya saja dalam keadaan padat (Brady, 1990: 698).
Ion Berwarna
Tingkat energi elektron pada unsur-unsur transisi yang hampir sama menyebabkan timbulnya warna pada ion-ion logam transisi. Hal ini terjadi karena elektron dapat bergerak ke tingkat yang lebih tinggi dengan mengabsorpsi sinar tampak. Pada golongan transisi, subkulit 3d yang belum terisi penuh menyebabkan elektron pada subkulit itu menyerap energi cahaya, sehingga elektronnya tereksitasi dan memancarkan energi cahaya dengan warna yang sesuai dengan warna cahaya yang dapat dipantulkan pada saat kembali ke keadaan dasar.
Misalnya Ti2+ berwarna ungu, Ti4+ tidak berwarna, Co2+ berwarna merah muda, Co3+ berwarna biru, dan lain sebagainya.
Beberapa kegunaan unsur-unsur transisi :
- Skandium, digunakan pada lampu intensitas tinggi.
- Titanium, digunakan pada industri pesawat terbang dan industri kimia (pemutih kertas, kaca, keramik, dan kosmetik).
- Vanadium, digunakan sebagai katalis pada pembuatan asam sulfat.
- Kromium, digunakan sebagai plating logam-logam lainnya.
- Mangan, digunakan pada produksi baja dan umumnya alloy mangan-besi.
- Besi, digunakan pada perangkat elektronik.
- Kobalt, digunakan untuk membuat aliansi logam.
- Nikel, digunakan untuk melapisi logam supaya tahan karat, membuat monel.
- Tembaga, digunakan pada alat-alat elektronik dan perhiasan.
- Seng, digunakan sebagai bahan cat putih, antioksidan pada pembuatan ban mobil, dan bahan untuk melapisi tabung gambar televisi.
Simak Juga : Soal Unsur Transisi Periode 4 dan Pembahasan
Ion Kompleks
Semua unsur transisi dapat membentuk ion kompleks, yaitu suatu struktur dimana kation logam dikelilingi oleh dua atau lebih anion atau molekul netral yang disebut ligan. Antara ion pusat dengan ligan terjadi ikatan kovalen koordinasi, dimana ligan berfungsi sebagai basa Lewis (penyedia pasangan elektron).
Contoh:
[Cu(H2O)4]2+
[Fe(CN)6]4–
[Cr(NH3)4Cl2]+
Senyawa unsur transisi umumnya berwarna. Hal ini disebabkan perpindahan elektron yang terjadi pada pengisian subkulit d dengan pengabsorbsi sinar tampak. Senyawa Sc dan Zn tidak berwarna.
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia



