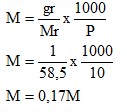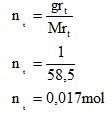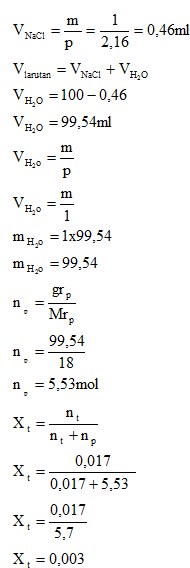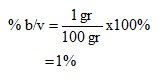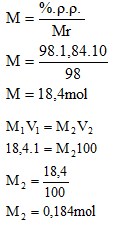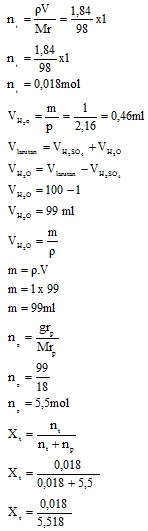Laporan Praktikum Pembuatan Larutan (Kimia Dasar I)
Download Laporan Praktikum Pembuatan Larutan dalam format word (.doc) agar mudah dibaca dan tertata rapi lengkap.
Google Drive | Mirror (Zippyshare, Mediafire, Openload)
BAB 1 : PENDAHULUAN
Latar Belakang
Dalam kehidupan sehari – hari kita tidak lepas dari yang namanya larutan, karena larutan memegang peranan yang penting dalam kehidupan mahkluk hidup. Misalnya mahkluk hidup menyerap mineral, vitamin, dan makanan dalam bentuk larutan. Larutan merupakan campuran homogen yang dapat berupa gas, cairan, maupun padatan. Larutan terdiri atas dua komponen penting yaitu zat terlarut (solute) dan zat pelarut (solvent) dalam proporsi tertentu.
Hampir sama proses kimia berlangsung dalam larutan sehingga penting untuk memahami sifat – sifatnya. Larutan adalah sesuatu yang penting bagi manusia dan mahkluk hidup pada umumnya. Reaksi – reaksi kimia biasanya berlangsung antara dua campuran, bukannya antara dua zat murni. Banyak reaksi kimia yang dikenal baik di dalam laboraturium ataupun didalam industri.
Baca Juga : Kategori Laporan
Larutan memainkan peran penting dalam kehidupan sehari – hari. Di alam kebanyakan reaksi berlangsung di dalam larutan air. Konsentrasi adalah kuantitas suatu zat tertentu di dalam larutan. Konsentrasi merupakan salah satu faktor penting yang menentukan cepat atau lambatnya reaksi berlangsung.
Konsentrasi larutan menyatakan banyaknya zat terlarut yang terdapat dalam suatu pelarut atau larutan. Larutan yang mengandung sebagian besar solute relatif terhadap pelarut, berarti larutan tersebut konsenstrasinya tinggi atau pekat. Sebaliknya bila mengandung sejumlah kecil solute, maka konsentrasinya rendah atau encer. Pada umumnya larutan mempunyai beberapa sifat. Diantaranya sifat larutan non elektrolit dan elektrolit.
Oleh karena itu, untuk mengetahui larutan lebih lanjut dan bagaimana cara pembuatan larutan serta mengetahui konsentrasi suatu larutan dengan beberapa cara seperti molaritas, fraksi mol, dan lain sebagainya. Percobaan ini dilakukan agar dapat memahami semua itu.
Tujuan
- Mengetahui pembuatan larutan dari bahan cair dan padat.
- Mengetahui berbagai cara menyatakan konsentrasi.
- Mengetahui konsentrasi larutan.
BAB 2 : TINJAUAN PUSTAKA
Larutan merupakan campuran zat-zat yang bersifat homogen yang memiliki komposisi merata atau serba sama diseluruh bagian volumenya. Suatu larutan mengandung komponen penting, zat terlarut dan zat pelarut. Zat terlarut atau solute merupakan komponen yang jumlahnya sedikit. Zat pelarut atau solvent merupakan komponen yang jumlahnya banyak (Achmad,1996).
Campuran pada dasarnya dibagi menjadi dua, yaitu:
- Campuran homogen adalah penggabungan dua zat tunggal atau lebih yang partikelnya menyebar merata sehingga membentuk 1 fase. Yang disebut 1 fase adalah zat yang komposisinya sama antara satu bagian dengan bagian yang lain didekatnya.
- Campuran heterogen adalah penggabungan yang tidak merata antara dua zat tunggal atau lebih sehingga perbandingan komponen yang satu dengan yang lainnya tidak sama diberbagai bagian bejana. Dalam campuran heterogen masih ada bidang batas antara dua komponen atau mengandung lebih dari 1 fasa(Syukri,1999).
Suatu larutan dengan jumlah maksimum zat terlarut pada temperatur tertentu disebut larutan jenuh. Sebelum suatu larutan mencapai titik jenuh, larutan tersebut diuapkan tidak jenuh. Kadang-kadang dijumpai suatu keadaan dengan zat terlarut.
Baca Juga : Laporan Praktikum Larutan Elektrolit dan non Elektrolit [+ Pembahasan]
Yang seharusnya dapat melarut pada temperatur tersebut. Larutan demikian disebut sebagai larutan lewat jenuh. Banyaknya zat terlarut yang dapat menghasilkan larutan jenuh dalam jumlah tertentu pelarut pada temperatur konstan disebut kelarutan. Kelarutan suatu zat bergantung pada zat itu, molekul pelarut, temperatur, dan tekanan.
Meskipun larutan dapat mengandung banyak komponen, tetapi pada tinjauan ini hanya dibahas larutan yang mengandung dua komponen. Yaitu larutan biner. Komponen dari larutan biner yaitu pelarut dan zat terlarut (Syukri,1999).
Jenis larutan berdasarkan zat terlarut dan pelarutnya, larutan dibedakan menjadi Sembilan yaitu:
- Larutan gas dalam gas. Contoh: Udara
- Larutan gas didalam cairan Contoh: Air terkarbonisasi
- Larutan gas dalam padatan Contoh: Hidrogen dalam logam
- Larutan cairan dalam gas. Contoh: Uap air diudara.
- Larutan cairan dalam cairan. Contoh: Alkohol dalam air
- Larutan cairan dalam padatan. Contoh: Air dalam kayu
- Larutan padat dalam gas. Contoh: Aroma
- Larutan padat dalam cairan. Contoh: Air gula
- Larutan padat dalam padatan. Contoh: Baja campuran besi dan karbon
(Khopkar,2003)
Jenis larutan berdasarkan kemampuannya menghantarkan arus listrik dibedakan menjadi dua, yaitu :
- Larutan elektrolit: larutan yang dapat menghantarkan listrik
- Larutan non elektrolit: larutan yang tidak dapat menghantarkan listrik (Khopkar,2003).
Sifat fisik dan Kimia NaCl
- Keadaan fisik dan penampilan: solid
- Beraroma: sedikit
- Rasa larutan: garam
- Berat molekul: 54,44 g/mol
- Warna larutan: putih
- Titik didih: 1413oC (2575,4 oF)
- Titik leleh: 801oC (1473,8oF)
- Kelarutan: mudah larut dalam air dingin dan panas. Larut dalam gliserol dan ammonia sangat sedikit larut dalam alkohol. Dan tidak larut dalam asam klorida (Achmad,2001).
Sifat fisik dan kima H2SO4
- Keadaan fisik dan penampilan: cairan
- Beraroma
- Rasa larutan: asam.
- Berat molekul: 95,08 g/mol
- Warna: tak berwarna
- Titik didih: 270oC (518oF) – 340 deg.C
- Titik leleh: -35oC (-31oF) menjadi 10,36 deg.C (93% sampai dengan 100%)
- Kelarutan: mudah larut dalam air dingin. Sulfat larut dalam air dengan pembebasan banyak panas. Larut dalam etil alkohol (Achmad,2001).
Konsenterasi didefinisikan sebagai jumlah zat terlarut dalam setiap satuan larutan atau pelarut, dinyatakan dalam satuan volume (berat,mol) zat terlarut dalam sejumlah volume (berat,mol) tertentu dari pelarut. Berdasarkan hal ini muncul satuan konsenterasi yaitu:
- Fraksi mol: Perbandingan dari jumlah mol dari suatu komponen dengan jumlah total mol dalam larutan. Memiliki rumus :
- Molaritas: Jumlah mol solute perliter larutan dan biasanya dinyatakan dalam M. Misal suatu larutan 6,0 molar HCl ditulis 6,0M. berarti bahwa larutan dibuat dengan menambah 6,0 M HCl pada air yang cukup dan kemudian volume larutan dibuat menjadi satu liter. Molaritas dinyatakan dalam rumus :
- Molalitas: Jumlah mol solute per satu kilogram solvent. Molalitas biasanya ditulis dengan m. Dimisalkan suatu larutanbertuliskan 6,0 m HCl dibaca 6,0 molal. Molalitas dinyatakan dalam rumus :
- Normalitas: Jumlah gram ekuivalen solute per liter larutan. Biasanya diisi dengan hufur besar N. Dimisalkan suatu larutanulisan 0,25 N KMnO4 dibaca 0,25 Normal. Normalitas dinyatakan dalam rumus
- Persen: Persen dari solute dapat dinyatakan sebagai persen berat atau persen volume. Sebagai contoh 3% berat adalah 3 gram H2O2 tiap 100 gram. Sedangkan 1% volume adalah satuan larutan yang dibuat dari 1 ml alkohol dan solvent di tambahkan hingga volume menjadi 100ml.
Faktor- fator yang mempengaruhi kelarutan: temperatur, sifat pelarut, efek ion sejenis, efek ion berlainan, pH, hidrolisis, pengaruh kompleks (Achmad,2001).
Air berperan sebagai pelarut universal karena air merupakan zat yang mampu melarutkan dan mengurai banyak zat. Suatu zat yang larut dalam air berarti zat tersebut merata dalam air. Sebagian zat hanya larut saja dalam air dan tidak terurai (Syukri,1999).
BAB 3 METODOLOGI PERCOBAAN
3.1 Alat dan Bahan
3.1.1 Alat
– Gelas kimia
– Gelas ukur
– Stopwatch
– Penangkas air
– Termometer
– Botol semprot
3.1.2 Bahan
– Larutan Na2S2O3 0,2 M
– Larutan Na2S2O3 0,1M
– Larutan HCl 0,1 M
– Larutan HCl 0,2 M
– Larutan HCl 0,3 M
– Tisu
– Kertas
– Kertas label
3.2 Prosedur Percobaan
3.2.1 Pengaruh konsentrasi terhadap laju reaksi
– Disiapkan 3 gelas kimia
– Diambil 1 gelas kimia dan diisi dengan 10ml Na2S2O3 0,2M kemudian
letakan diatas kertas putih yang telah diberi tanda silang.
– Dimasukan 10ml HCl 0,1M kedalam gelas kimia yang telah diisi dengan
10ml Na2S2O3 0,2M.
– Dicatat waktu yang diperlukan campuran tersebut untuk beraksi hingga
tanda silang pada kertas yang diletakan dibawah gelas kimia tak terlihat lagi dari atas dengan menggunakan stopwatch.
- Ulangi percobaan dengan langkah yang sama dengaan larutan 10ml
Na2S2O3 0,1M dengan larutan 10ml HCl 0,3M. Kemudian ulangi lagi
dengan larutan 10ml Na2S2O3 0,2M dengan 10ml HCl 0,3M.
3.2.2 Pengaruh suhu terhadap laju reaksi
– Disiapkan 3 gelas kimia
– Diambil 1 gelas kimia dan diisi dengan 10ml Na2S2O3 0,2M.
– Dipanaskan larutan tersebut pada penangkas air hingga mencapai 40oC
– Diletakan gelas kimia tersebut diatas kertas putih yang telah diberi tanda
silang.
– Dimasukan 10ml HCl 0,1M kedalam gelas kimia tersebut.
– Dicatat waktu yang diperlukan campuran larutan tersebut untuk bereaksi
hingga tanda silang tidak terlihat lagi dari atas.
– Diulangi percobaan dengan langkah yang sama dengan larutan 10ml
Na2S2O3 0,1M dengan 10ml HCl 0,1M dengan suhu 60oC.
BAB 4 : HASIL DAN PENGAMATAN
4.1 Hasil Pengamatan
4.1.1 Tabel Hasil Pengamatan
| No | Nama Larutan | konsentrasi | |
| 1. | Larutan NaCl | Molaritas | 0,17 M |
| Fraksi mol | 0,003 | ||
| Persen b/v | 1% | ||
| 2. | Larutan H2SO4 | Molaritas | 0,184 M |
| Fraksi mol | 0,003 | ||
4.2 Reaksi
4.2.1 Pembuatan larutan dengan bahan zat padat
NaCl(s) + H2O(l) → Na+ + Cl– +H2O
4.2.2 Pembuatan larutan dengan bahan zat cair
H2SO4(l) + H2O → 2H+ + SO4-2 + + H2O
4.3 Perhitungan
4.3.1 Larutan NaCl
- Molaritas
- Fraksi Mol
- Persen
4.2.2 Larutan H2SO4
- Molaritas
- Fraksi Mol
4.3 Pembahasan
Pada praktikum pembuatan larutan kali ini dilakukan dengan dua kali percobaan. Pada percoban pertama dilakukan palarutan dengan nilai tertentu dimana padatan NaCl digunakan sebagai zat yang terlarut. Percobaan ini dilakukan untuk membuat larutan dengan volume 100ml. Pada percobaan ini NaCl yang dibutuhkan adalah 1gr.
Kemudian NaCl ditimbang dengan menggunkan neraca analitik. Pada saat NaCl ditimbang dengan menggunakan neraca analitik, kaca arlogi digunakan sebagai wadah untuk NaCl agar dapat ditimbang dengan menggunakan neraca analitik. Selanjutnya NaCl yang telah ditimbang dipindahkan dan dimasukan kedalam gelas kimia dan ditambahkan 50ml aquadest.
Kemudian aduk larutan tersebut dengan menggunakan batang pengaduk hingga NaCl larut dalam aquadest. Selanjutnya larutan tersebut dimasukan kedalam labu takar 100ml dan ditambahkan aquadest hingga lengkungan pada bagian bawah permukan larutan sejajar dengan batas pada leher labu takar 100ml. Kemudian lap sisa aquadest berupa titik yang menempel pada leher labu takar. Homogenkan larutan tersebut dengan cara dibolak – balikan labu takar agar larutan benar – benar tercampur dengan sempurna.
Baca Juga : Laporan Praktikum Koloid Tentang Percobaan Cahaya
Pada percobaan kedua, bahan yang digunakan adalah H2SO4 berupa zat cair. Pada percobaan ini dibutuhkan 1ml larutan H2SO4. Mula – mula aquadest 50ml dimasukan kedalam gelas kimia 100ml kemudian ditambahkan 1ml H2SO4.
Larutan tersebut kemudian diaduk dan selanjutnya dipindahkan larutan yang telah tercampur tersebut kedalam labu takar 100ml. Bilas gelas kimi yang sebelumnya digunakan dan tambahkan aquadest hingga cekungan yang berada pada bagian bawah permukan larutan sejajar dengan garis batas pada dinding labu takar.
Kemudian dikeringkan sisa – sisa aquadest yang masih menempel pada dinding leher labu takar. Kemudian larutan tersebut dihomogenkan agar tercampur sempurna.
Dari kedua percobaan yang telah dilakukan didapati konsentrasi pada larutan NaCl dan H2SO4. Untuk larutan NaCl didapatkan molrits sebesar 0,17M dengan fraksi mol 0,003 dan persen b/v didapatkan 1%.
Sedangkan untuk larutan H2SO4 didapatkan molaritas sebesar 0,184M dengan fraksi mol sebesar 0,003.
Pada praktikum kali ini terdapat perbedaan antara percobaan pertama dengan percobaan kedua. Perberdaan tersebut terletak pada bahan yang digunakan dimana pada percobaan pertama digunakan NaCl berupa padatan dan pada percobaan kedua digunakan H2SO4 berupa cairan.
Selain itu perbedaan antara percobaan pertama dengan percobaan kedua terletak pada zat terlarut dimana pada percobaan pertama yang merupakan zat terlarut adalah NaCl sedangkan pada percobaan kedua yang menjadi zat terlarut adalah H2SO4.
Perbedaan keduanya juga terletak pada prosedur percobaan dimana pada percobaan pertama aquadest dimasukan setelah NCl terlebih dahulu berada dalam gelas kimia sedangkan pada percobaan kedua aquadest dimasukan kedalam gelas kimia sebelum H2SO4.
Fungsi perlakuan dalam praktikum ini yaitu menghomogenkan larutan agar larutan dapat tercampur dengan sempurna. Dibilas kaca arloji agar massa NaCl yang digunakan dalam percobaan pertama tidak berubah. Dicuci semua alat yang digunakan hingga bersih agar diperoleh alat yang steril sehingga tidak mempengaruhi konsentrasi larutan yang lain.
Dimasukan aquadest terlebih dahulu kedalam gelas kimia sebelum H2SO4 adalah untuk menghindari percikan yang dapat terjadi jika H2SO4 dimasukan terlebih dahulu sebelum aquadest. Dikeringkan semua titik titik aquadest yang menempel pada dinding leher labu takar dengan menggunakan batang pengaduk yang dilapisi tisu agar volume aquadest tidak bertambah pada saat larutan dihomogenkan.
Ditambahkan aquadest bekas bilasan adalah untuk mempertahankan volume larutan yang telah tercampur dan mempertahankan massa NaCl sehingga volume larutan yang telah tercampur dan massa NaCl tidak berkurang.
Faktor kesalahan pada percobaan ini yaitu pada saat ditambahkannya aquadest hingga cekungan pada permukaan larutan bagian bawah sejajar dengan pembatas pada dinding leher labu takar tidak dilakukan dengan benar. Dimana aquadest yang ditambahkan melewati pembatas tersebut sehingga percobaan dilakukan dua kali
BAB 5 : PENUTUP
5.1 Kesimpulan
Berdasarkan hasil percobaan yang dilakukan dapat ditarik kesimpulan bahwa :
- Pembuatan larutan dari bahan padatan, hal pertama yang haru dilakukan adalah pelarutan terlebih dahulu sebelum dicampur dengan air. Begitu juga dengan pelarutan dari bahan cairan harus dilakukan pengenceran namun hal ini hanya berlaku untuk cairan yang bersifat pekat.
- Cara – cara untuk menyatakan konsentrasi ada bebrapa cara seperti dengan mencari molaritasnya, molalitas, fraksi mol, dan perbandingan massa serta perbandingan volume.
- Konsentrasi yang didapatkan dari pelarutan NaCl adalah molaritas sebesar 0,17 M, Fraksi mol 0,003, dan persen volume NaCl pada larutan sebesar 1%. Pada pelarutan H2SO4 adalah molaritas sebesar 0,184 M dan Fraksi mol sebesar 0,003.
5.2 Saran
Sebaiknya pada praktikum selanjutnya digunakan bahan lain seperti HCl, NaOH, gula dan lain – lain. Agar dapat memahami lebih banyak tentang pembuatan larutan dan menentukan konstentrasi dengan cara lainnya.
DAFTAR PUSTAKA
Achmad,Hiskia. 2001. Kimia larutan. Bandung : Citra Aditya Bakti.
Khopkar,S.M.1990. Konsep Dasar Kimia.Analitik. Jakarta : Universitas Indonesia.
Syukri,S.1999. Kimia Dasar 2. Bandung:ITB.