Laporan Praktikum larutan Elektrolit dan non elektrolit
Kali ini Tim kimia space akan membagikan laporan praktikum elektrolit dan non elektrolit lengkap dengan pembahasannya untuk kamu pelajari.
Tujuan Percobaan Praktikum Larutan Elektrolit
- Merancang dan melakukan percobaan untuk mengidentifikasi sifat-sifat larutan elektrolit dan non elektrolit dalam diskusi kelompok dilaboratorium.
- Menyimpulkan perbedaan sifat dan jenis larutan elektrolit dan non elektrolit.
Dasar Teori
Untuk pemahaman sebelum melakukan praktikum larutan elektrolit dan non elektrolit.
Selain dari ikatannya, terdapat cara lain untuk mengelompokan senyawa yakni didasarkan pada daya hantar listrik. Jika suatu senyawa dilarutkan dalam air dapat menghantarkan arus listrik disebut larutan elektrolit, dan sebaliknya jika larutan tersebut tidak dapat menghantarkan arus listrik disebut larutan nonelektrolit.
Glukosa (C6H12O6), etanol (C2H5OH), gula tebu (C12H22O11), larutan urea (CO(NH2)2) merupakan beberapa contoh senyawa yang dalam bentuk padatan, lelehan maupun larutan tidak dapat menghantarkan arus listrik.
Larutan elektrolit dapat berupa asam, basa dan garam. Untuk asam dan basa dapat berupa elektrolit kuat dan elektrolit lemah. Sedangkan garam yang mudah larut dalam air semuanya termasuk elektrolit kuat. Garam-garam yang sukar larut dalam air berupa elektrolit lemah walaupun tersusun atas ion-ion.
Beberapa senyawa yang tergolong elektrolit kuat adalah Asam-asam kuat umumnya asam-asam anorganik, misalnya: HCl, HClO3, H2SO4 dan HNO3. Kemudian Basa-basa kuat yaitu basa-basa golongan alkali dan alkali tanah, misalnya: NaOH, KOH, Ca(OH)2 dan Ba(OH)2. Dan Garam-garam yang mudah larut, misalnya: NaCl, KI dan Al2(SO4)3
Beberapa senyawa yang tergolong elektrolit lemah seperti Asam-asam lemah, sebagian asam anorganik dan sebagian besar asam organik misalnya: CH3COOH, HCN, H2CO3 dan H2S. Basa-basa lemah, misalnya amonia dan kebanyakan basa organik seperti NH4OH dan Ni(OH)2. Dan Garam-garam yang sukar larut,
misalnya:
- AgCl,
- CaCrO4 dan
- PbI2
Larutan elektrolit merupakan larutan yang dapat menghantarkan listrik, karena mengandung ion-ion yang dapat bergerak bebas. Ion-ion itulah yang menghantar arus listrik melalui larutan. Semakin banyak ion yang dihasilkan semakin baik pula larutan tersebut menghantarkan listrik.
Senyawa yang seluruhnya atau hampir seluruhnya di dalam air terurai menjadi ion-ion sehingga memiliki daya hantar listrik yang baik disebut elektrolit kuat.
Baca Juga : Laporan Praktikum Koloid Tentang Percobaan Cahaya
Senyawa yang termasuk elektrolit kuat mempunyai daya hantar listrik yang relatif baik walaupun memiliki konsentrasi yang kecil. Sebaliknya senyawa yang sebagian kecil terurai menjadi ion disebut elektrolit lemah. Senyawa yang termasuk elektrolit lemah mempunyai daya hantar yang relatif jelek walaupun memiliki konsentrasi tinggi (pekat).
Larutan Non elektrolit merupajkan larutan yang tidak dapat menghantar listrik, karena zat non elektrolit dalam larutan tidak terurai menjadi ion-ion, tetapi tetap berupa molekul.Seperti larutan gula, urea, minyak tanah, bensin, alkohol dll.
Perubahan suatu senyawa menjadi ion-ion dalam suatu larutan disebut proses ionisasi. Proses ionisasi merupakan salah satu cara menunjukan pembentukan ion-ion, umumnya ditulis tanpa melibatkan molekul air atau pelarut, namun terkadang molekul air dituliskan juga. Misalnya HCl yang dilarutkan dalam air dapat ditulis dalam dua persamaan: HCl → H+ + Cl–
Ketika diberi beda potensial, Ion yang bermuatan negatif bergerak menuju anoda (+) sedangkan ion yang bermuatan positif bergerak menuju katoda (-) karena adanya perbedaan muatan. Aliran ion inilah yang menyebabkan larutan elektrolit dapat menghantarkan arus listrik.
Senyawa seperti glukosa, etanol, gula tebu dan larutan urea dalam bentuk padatan, lelehan maupun larutan tidak dapat menghantarkan arus listrik karena tidak mengalami ionisasi atau tetap dalam bentuk molekul.
Sumber Ion Dalam Larutan Elektrolit
Ion-ion yang timbul dalam larutan elektrolit terdiri dari dua sumber yaitu senyawa ionik dan senyawa kovalen polar.
Senyawa ionik tersusun atas ion-ion sekalipun dalam dalam bentuk padat atau kering. Misalnya NaCl dan NaOH. NaCl tersusun dari ion Na+ dan ion Cl¯ sedangkan NaOH tersusun dari ion Na+ dan ion OH–.
Senyawa-senyawa ionik dalam keadaan padat tidak dapat menghantarkan arus listrik karena ion-ion yang terikata dengan kuat, sehingga tidak ion-ion tersebut tidak mengalami mobilisasi ketika diberi beda potensial. Namun apabila senyawa ionik dilarutkan dalam pelarut polar misalnya air, maka senyawa ionik adalah suatu elektrolit.
Hal ini disebabkan ion-ion yang awalnya terikat kuat pada kisi terlepas kemudian segera masuk dan menyebar dengan air sebagai medium untuk bergerak.
Perlu diketahui bahwa semua senyawa ionik yang yang dapat larut dalam pelarut polar seperti air dan lelehan senyawa ionik merupakan suatu elektrolit.
Tetapi lelehan senyawa ionik memiliki daya hantar listrik yang lebih baik dibanding larutannya. Hal ini disebabkan susunan ion-ion dalam lelehan senyawa ionik lebih rapat dibanding dalam bentuk larutan, sehingga ion-ion yang ada lebih mudah atau lebih cepat bergerak menuju anoda dan katoda ketika diberi beda potensial.
Senyawa-senyawa kovalen baik kovalen polar maupun nonpolar dalam keadaan murni tidak dapat menghantarkan arus listrik. Tetapi senyawa kovalen polar dapat menghantarkan arus listrik jika dilarutkan dalam pelarut yang sesuai. Hal ini disebabkan senyawa kovalen polar dalam pelarut yang sesuai mampu membentuk ion-ion.
Contoh
Misalnya senyawa kovalen polar mampu membentuk ion di dalam air sehingga dapat menghantar arus listrik. Tetapi senyawa kovalen polar tidak mampu membentuk ion di dalam benzena sehingga tidak dapat menghantarkan arus listrik. HCl, NH3 dan CH3COOH merupakan beberapa contoh senyawa kovalen polar.
Larutan yang memberikan nyala bohlam terang termasuk elektrolit kuat sedangkan elektrolit lemah nyala bohlamnya redup atau hanya menimbulkan gelembung-gelumbung udara pada elektroda. Jika tidak ada reaksi atau perubahan apa-apa ketika kedua elektroda dicelupkan, maka larutan tersebut termasuk larutan nonelektrolit.
Contoh
Misalnya HCl, CH3COOH dan NH3, apabila diuji daya hantar listrik menggunakan konsentrasi larutan yang sama misalnya 1 M. Maka dapat diketahui ternyata HCl memiliki daya hantar listrik yang lebih baik dibanding dua senyawa lainnya. Hal ini dapat dilihat dari lampu bohlam yang menyala lebih terang. Menggunakan teori Arhenius dapat disimpulkan bahwa jumlah ion yang terbentuk dari HCl lebih banyak dibanding dua senyawa lainnya. Artinya di dalam air sebagian besar HCl terurai menjadi ion H+ dan ion Cl‾ sedangkan CH3COOH dan NH3 hanya sebagian kecil yang terurai ion H+ dan ion CH3COO‾ dan NH4+ dan OH‾ atau sebagian besarnya masih tetap dalam bentuk molekul kovalen.
Derajat Ionisasi
Ketika suatu zat dilarutkan dalam air, maka terdapat 3 kemungkinan yang terjadi yakni zat tersebut larut secara sempurna, larut sebagian dan tidak larut dalam air. Banyaknya spesi yang terionisasi dalam air dapat diketahui menggunakan derajat disosiasi atau derajat ionisasi (α). Derajat ionisasi diartikan sebagai perbandingan jumlah mol atau molekul zat yang terionisasi dengan banyaknya mol atau molekul zat mula-mula. Derajat ionisasi dapat ditulis sebagai :
Harga α di antara 0 ≤ α ≥ 1. α ≤ 0 artinya tidak terjadi ionisasi, sedangkan α ≥ 1 artinya terjadi ionisasi secara sempurna.
Alat dan Bahan
- Lampu led 6 volt
- Kabel
- Elektroda (2buah paku)
- Batu batre 9 volt
- Gelas Kimia
Prosedur
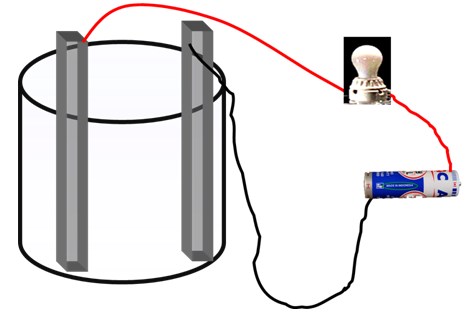
- Rangkai alat seperti pada gambar dibawah ini:
- Masukkan larutan yang akan diuji kedalam gelas kimia, masukkan kedua elektroda( jangan saling bersentuhan) kedalam larutan.
- Amati apa yang terjadi
Data Hasil Pengamatan
| NO | LARUTAN | PENGAMATAN | DAYA HANTAR LISTRIKMENGGUNAKAN VOLT METER |
| 1. | Pemutih | • Lampu Menyala terang
• Timbul Gelembung Gas | • 36 volt |
| 2. | mentimun | • Lampu tidak menyala
• Timbul bayak Gelembung Gas | • 34 volt |
| 3. | Susu cair | • Lampu Tak Menyala
• Timbul sedikit Gelembung Gas | • 27 volt |
Pembahasan
Keelektrolitan suatu larutan dapat diketahui dengan alat uji elektrolit. Beikut hasil analisa dari percobaan yang sudah dilakukan :Larutan-larutan tersebut ada yang bisa menyalakan lampu ada pula yang tidak, ada yang menghasilkan gelembung ada pula yang tidak. Larutan yang menimbulkan gelembung adalah larutan elektrolit, sedangkan yang tidak adalah larutan non-elektrolit.
Larutan yang dapat menghantarkan listrik dengan baik (ditunjukkan dengan lampu yang menyala terang) karena dapat terionisasi dengan baik (ditunjukkan dengan adanya gelembung-gelembung) merupakan larutan elektrolit kuat.
Baca Juga : 45+ Soal Sifat Koligatif Larutan Pilihan Ganda dan Pembahasan Simpel
Larutan yang dapat menghantarkan listrik dengan buruk (ditunjukkan dengan lampu yang menyala redup atau tidak menyala sama sekali) karena tidak dapat terionisasi dengan baik (ditunjukkan dengan masih adanya gelembung-gelembung) merupakan larutan elektrolit lemah.Larutan yang tidak dapat menghantarkan listrik sama sekali (ditunjukkan dengan lampu yang sama sekali tidak menyala) karena tidak dapat terionisasi sama sekali (ditunjukkan dengan tidak adanya gelembung-gelembung) merupakan larutan non-elektrolit.
Alat voltmeter merupakan alat pengukur tegangan listirk. Jarum alat pengukur voltmeter akan bergerak saat ada arus listrik. Semakin besar arus listrik yang mengalir, maka semakin besar penyimpangan jarum yang terjadi.
Berdasarkan hasil percobaan yaitu dengan masing-masing larutan uji dengan alat uji elektroda dan mengamati ada/ tidaknya nyala lampu dan gelembung-gelembung. Dan menggunakan alat voltmeter sebagai pengukur tegangan listrik yang dimiliki. Maka beberapa larutan uji tersebut digolongkan kedalam tiga golongan yaitu, larutan elektrolit kuat, larutan elektrolit lemah dan larutan non elektrolit.
Baca Juga : Kategori Laporan selain Laporan Praktikum Elektrolit dan Non Elektrolit
Dalam percobaan ini digunakan tiga sampel/ bahan yaitu, larutan pemutih, perasan mentimun, dan susu cair. Tiga sampel ini akan diuji berdasarkan sifat larutannya, apakah bisa menghantarkan listrik atau justru sebaliknya.
Dalam pengujian elektrolit ini, yang pertama dilakukan yaitu memasukkan larutan pemutih kedalam gelas kimia . setelah itu, celupkan alat uji elektroda kedalam gelas kimia yang berisi larutan pemutih dan terbukti bahwa larutan pemutih menghasilkan nyala lampu yang terang dan gelembung yang banyak yang berarti bersifat elektrolit kuat.
Reaksi ionisasi elektrolit kuat merupakan reaksi berkesudahan. Dalam larutan tidak ada lagi molekul elektrolit yang netral. Semuanya telah diubah menjadi ion-ion.
Hal ini disebabkan karena zat terlarut NaClO memang merupakan senyawa ion. NaClO yang dilarutkan dalam air akan membentuk ikatan antara ion positif dan ion negatif terputus dan ion-ion akan tersebar dan bergerak bebas didalam larutan.
NaClO → Na+ + ClO–
Pada larutan perasan mentimun, lampu tidak menyala namun gelembung yang muncul cukup banyak, menandakan bahwa perasan mentimun merupakan elektrolit lemah. Hal ini karena kandungan dalam mentimun (Cucumis sativus)per 100 gramnya memiliki kalium (147mg) yang merupakan elektrolit penting. Selain itu, kandungan antioksidan yang sangat baik terdapat pada mentimun. Senyawa antioksidan merupakan senyawa pemberi elektrn atau reduktan (Winarsi, 2007).
Selanjutnya pada percobaan terakhir pada susu cair, didapatkan hasil lampu tidak menyala dan terdapat sedikit gelembung. Hal ini menandakan bahwa susu cair merupaklarutan non elektrolit. Namun pada pengukuran voltmeter menunujukan angka 27 volt, yang berarti susu cair mengandug tegangan listrik. Dan menunjukkan bahwa susu cair merupakan larutan elektrolit yang lebih lemah dibanding mentimun. Karenakandungan yang dimiliki susu cair tersbet terdapat kalium sbanyak 8% dan vitamin C sebanyak 8%. Kedua kandungan tersbut merupakan sumber elektrolit.
KESIMPULAN
Larutan elektorit merupakan larutan yang dapat menghantarkan arus listrik. Dan larutan elektrolit merupakan larutan yang tidak dapat menghantarkan arus listrik. Larutan elektrolit dibagi dua, yaitu elektrolit kuat dan elektrolit lemah.
Dengan melakukan pengujian dengan arus listrik dan menggunakan alat voltmeter untuk mengukur tegangan listik yang dimiliki, maka pada percobaan ini dapat diketahui beberapa contoh larutan elektrolit yang sering ditemukan dalam kehidupan sehari hari. Diantaranya adalah larutan pemutih yang merupaka elektrolit kuat, perasan mentimun serta susu cair yang termasuk sebagai elektrolit lemah.
DAFTAR PUSTAKA
- S, Syukri. 1999. Kimia Dasar 2. Bandung : ITB
- Utami, Budi. 2004. Kimia Dasar. Bandung
- Winarsi, H. 2007. Antioksidan Alami Dan Radikal Bebas. Yogyakarta : Kanisius.
Unduh Laporan praktikum larutan elektrolit disini :