Pengertian Larutan Elektrolit dan Nonelektrolit Sifat – Sifat dan Contohnya – Materi dalam kelas 10 SMA tentang elektrolit akan siswa pelajari karena menjadi dasar untuk mempelajari reaksi redoks, kita harus tahu lebih dahulu yang mana larutan elektrolit dan non elektrolit.
1. Pendahuluan
Dalam kimia, larutan adalah campuran homogen yang terdiri dari dua atau lebih zat. Zat yang jumlahnya lebih sedikit di dalam larutan disebut (zat) terlarut atau solut, sedangkan zat yang jumlahnya lebih banyak daripada zat-zat lain dalam larutan disebut pelarut atau solven. Komposisi zat terlarut dan pelarut dalam larutan dinyatakan dalam konsentrasi larutan, sedangkan proses pencampuran zat terlarut dan pelarut membentuk larutan disebut pelarutan atau solvasi.
Contoh larutan yang umum dijumpai adalah padatan yang dilarutkan dalam cairan, seperti garam atau gula dilarutkan dalam air. Gas juga dapat pula dilarutkan dalam cairan, misalnya karbon dioksida atau oksigen dalam air. Selain itu, cairan dapat pula larut dalam cairan lain, sementara gas larut dalam gas lain. Terdapat pula larutan padat, misalnya aloi (campuran logam) dan mineral tertentu.
Baca Juga : 20+ Soal Larutan Elektrolit dan Non Elektrolit Pilihan Ganda [+ Pembahasan]
Konsentrasi
Konsentrasi larutan menyatakan secara kuantitatif komposisi zat terlarut dan pelarut di dalam larutan. Konsentrasi umumnya dinyatakan dalam perbandingan jumlah zat terlarut dengan jumlah total zat dalam larutan, atau dalam perbandingan jumlah zat terlarut dengan jumlah pelarut.
Contoh beberapa satuan konsentrasi adalah molar, molal, dan bagian per juta (part per million, ppm). Sementara itu, secara kualitatif, komposisi larutan dapat dinyatakan sebagai encer (berkonsentrasi rendah) atau pekat (berkonsentrasi tinggi).
Pelarutan
Molekul komponen-komponen larutan berinteraksi langsung dalam keadaan tercampur. Pada proses pelarutan, tarikan antarpartikel komponen murni terpecah dan tergantikan dengan tarikan antara pelarut dengan zat terlarut.
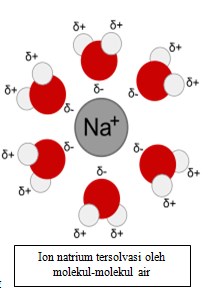
Terutama jika pelarut dan zat terlarut sama-sama polar, akan terbentuk suatu sruktur zat pelarut mengelilingi zat terlarut; hal ini memungkinkan interaksi antara zat terlarut dan pelarut tetap stabil.
Bila komponen zat terlarut ditambahkan terus-menerus ke dalam pelarut, pada suatu titik komponen yang ditambahkan tidak akan dapat larut lagi. Misalnya, jika zat terlarutnya berupa padatan dan pelarutnya berupa cairan, pada suatu titik padatan tersebut tidak dapat larut lagi dan terbentuklah endapan. Jumlah zat terlarut dalam larutan tersebut adalah maksimal, dan larutannya disebut sebagai larutan jenuh.
Titik tercapainya keadaan jenuh larutan sangat dipengaruhi oleh berbagai faktor lingkungan, seperti suhu, tekanan, dan kontaminasi. Secara umum, kelarutan suatu zat (yaitu jumlah suatu zat yang dapat terlarut dalam pelarut tertentu) sebanding terhadap suhu.
Hal ini terutama berlaku pada zat padat, walaupun ada perkecualian. Kelarutan zat cair dalam zat cair lainnya secara umum kurang peka terhadap suhu daripada kelarutan padatan atau gas dalam zat cair. Kelarutan gas dalam air umumnya berbanding terbalik terhadap suhu.
2. Larutan elektrolit dan non elektrolit
Mari kita kembali ke pokok bahasan ini. Pastinya kita pernah melihat orang melakukan penangkapan ikan dengan alat setrom listrik yang sumber arusnya berasal dari aki; atau kalian pernah mendengar penyataan jika kita menyentuh stop kontak dalam kondisi tangan basah, kemungkinan besar akan kesetrom.
Apa yang menjadi faktor penyebab dari semua perilaku ini? Mengapa ikan bisa mati jika alat setrom dicelupkan kedalam air? Bukankah penghantar listrik erat kaitannya dengan suatu bahan logam? Pertanyaan-pertanyaan ini akan kita bahas di sini.
Suatu larutan dapat dikatakan sebagai larutan elektrolit jika zat tersebut mampu menghantarkan listrik. Mengapa zat elektrolit dapat menghantarkan listrik? Ini erat kaitannya dengan ion-ion yang dihasilkan oleh larutan elektrolit (baik positif maupun negative). Suatu zat dapat menghantarkan listrik karena zat tersebut memiliki ion-ion yang bergerak bebas di dalam larutan tersebut. ion-ion inilah yang nantinya akan menjadi penghantar. Semakin banyak ion yang dihasilkan semakin baik pula larutan tersebut menghantarkan listrik.
Larutan Elektrolit merupakan suatu zat yang ketika dilarutkan dalam air akan menghasilkan larutan yang dapat menghasilkan arus listrik.
Larutan Nonelektrolit adalah tidak dapat menghantarkan arus listrik ketika dilarutkan dalam air.
3. Sejarah Larutan elektrolit dan non elektrolit
Pada tahun 1884, Svante Arrhenius, ahli kimia terkenal dari Swedia mengemukakan teori elektrolit yang sampai saat ini teori tersebut tetap bertahan padahal ia hampir saja tidak diberikan gelar doktornya di Universitas Upsala, Swedia, karena mengungkapkan teori ini. Menurut Arrhenius, larutan elektrolit dalam air terdisosiasi ke dalam partikel-partikel bermuatan listrik positif dan negatif yang disebut ion (ion positif dan ion negatif) Jumlah muatan ion positif akan sama dengan jumlah muatan ion negatif, sehingga muatan ion-ion dalam larutan netral. Ion-ion inilah yang bertugas mengahantarkan arus listrik. Larutan yang dapat menghantarkan arus listrik disebut larutan elektrolit.
Larutan ini memberikan gejala berupa menyalanya lampu atau timbulnya gelembung gas dalam larutan. Larutan elektrolit mengandung partikel-partikel yang bermuatan (kation dan anion). Berdasarkan percobaan yang dilakukan oleh Michael Faraday, diketahui bahwa jika arus listrik dialirkan ke dalam larutan elektrolit akan terjadi proses elektrolisis yang menghasilkan gas.
Gelembung gas ini terbentuk karena ion positif mengalami reaksi reduksi dan ion negatif mengalami oksidasi. Contoh, pada laruutan HCl terjadi reaksi elektrolisis yang menghasilkan gas hidrogen sebagai berikut.
HCl(aq)→ H+(aq) + Cl-(aq)
Reaksi reduksi : 2H‑(aq) + 2e– → H2(g)
Reaksi oksidasi : 2Cl-(aq) → Cl2(g) + 2e–
Pada larutan elektrolit kuat, seluruh molekulnya terurai menjadi ion-ion (terionisasi sempurna). Karena banyak ion yang dapat menghantarkan arus listrik, maka daya hantarnya kuat. pada persamaan reaksi, ionisasi elektrolit kuat ditandai dengan anak panah satu arah ke kanan.
Contoh :
NaCl(s) → Na+ (aq) + Cl- (aq)
4. Berbagai Jenis Larutan Elektrolit
Larutan apa saja yang dapat menghantarkan listrik? Terdapat berbagai jenis larutan yang bisa menghantarkan listrik. Pembagian zat tersebut adalah sebagai berikut.
Berdasarkan jenis larutan
1. Larutan asam (zat yang melepas ion H+ jika dilarutkan dalam air), contohnya adalah:
- Asam klorida/asam lambung : HCl
- Asam florida : HF
- Asam sulfat/air aki : H2SO4
- Asam asetat/cuka : CH3COOH
- Asam sianida : HCN
- Asam nitrat : HNO3
- Asam fospat : H3PO4
2. Larutan basa (zat yang melepas ion OH– jika dilarutkan dalam air), contohnya adalah:
- Natrium hidroksida/soda kaustik : NaOH
- Calcium hidroksida : Ca(OH)2
- Litium hidroksida : LiOH
- Kalium hidroksida : KOH
- Barium hidroksida : Ba(OH)2
- Magnesium hidroksida : Mg(OH)2
- Aluminium hidroksida : Al(OH)3
- Besi (II) hidroksida : Fe(OH)2
- Besi (III) hidroksida : Fe(OH)3
- Amonium hirdoksida : NH4OH
3. Larutan garam (zat yang terbentuk dari reaksi antara asam dan basa), contohnya adalah:
- Natrium klorida/garam dapur : NaCl
- Ammonium clorida : NH4Cl
- Ammonium sulfat : (NH4)2SO4
- Calcium diklorida : CaCl2
Berdasarkan jenis ikatan
- Senyawa ion (senyawa yang terbentuk melalui ikatan ion), contohnya adalah: NaCl, CaCl2, AlCl3, MgF2, LiF (sebagian besar berasal dari garam).
- Senyawa kovalen polar (senyawa melalui ikatan kovalen yang bersifat polar/memiliki perbedaan keelektronegatifan yang besar antar atom), contohnya adalah: HCl, NaOH, H2SO4, H3PO4, HNO3, Ba(OH)2 (berasal dari asam dan basa).
Sifat daya hantar listrik
Larutan tergolong ke dalam campuran homogen yang terdiri dari pelarut dan zat terlarut. Pelarut -pelarut yang biasa digunakan adalah air. Sedangkan zat terlarut terdiri dari berbagai senyawa ion maupun kovalen. sifat daya hantar listrik zat yang terlarut dalam air dapat diketahui dengan uji nyala.
| Jenis larutan | Sifat dan pengamatan lain | Contoh senyawa | Reaksi ionisasi |
|---|---|---|---|
| Elektrolit kuat | – Terionisasi sempurna – Menghantarkan arus listrik – Lampu menyala terang – Terdapat gelembung gas | NaCl, NaOH, H2SO4, HCl, dan KCl | NaCl → Na+ + Cl– NaOH → Na+ + OH– H2SO4 → H+ + SO42- HCl → H+ + Cl– KCl → K+ + Cl– |
| Elektrolit lemah | – Terionisasi sebagian – Menghantarkan arus listrik – Lampu menyala redup – Terdapat gelembung gas | CH3COOH, N4OH, HCN, dan Al(OH)3 | CH3COOH → H+ + CH3COO– HCN → H+ + CN– Al(OH)3 → Al3+ + OH– |
| Nonelektrolit | – Tidak terionisasi – Tidak menghantarkan arus listrik – Lampu tidak menyala – Tidak terdapat gelembung gas | C6H12O6 C12H22O11 CO(NH2)2 C2H5OH | C6H12O6 C12H22O11 CO(NH2)2 C2H5OH |
Penghantaran arus listrik
Larutan elektrolit terdapat ion-ion yang berbeda muatan dan bergerak bebas. Bila arus listrik dihubungkan, kation bergerak menuju katode dan anion bergerak menuju anode sehingga arus listrik mengalir dalam sistem tersebut.
5. Sifat – sifat dari larutan elektrolit dan non elektrolit
Elektrolit kuat, karakteristiknya adalah sebagai berikut:
- Menghasilkan banyak ion Molekul netral dalam larutan hanya sedikit/tidak ada sama sekali
- Terionisasi sempurna, atau sebagian besar terionisasi sempurna
- Jika dilakukan uji daya hantar listrik: gelembung gas yang dihasilkan banyak, lampu menyala
- Penghantar listrik yang baik
- Derajat ionisasi = 1, atau mendekati 1
- Contohnya adalah: asam kuat (HCl, H2SO4, H3PO4, HNO3, HF); basa kuat (NaOH, Ca(OH)2, Mg(OH)2, LiOH), garam NaCl
Elektrolit lemah, karakteristiknya adalah sebagai berikut:
- Menghasilkan sedikit ion
- Molekul netral dalam larutan banyak
- Terionisasi hanya sebagian kecil
- Jika dilakukan uji daya hantar listrik: gelembung gas yang dihasilkan sedikit, lampu tidak menyala
- Penghantar listrik yang buruk
- Derajat ionisasi mendekati 0
- Contohnya adalah: asam lemah (cuka, asam askorbat, asam semut), basa lemah (Al(OH)3, NH4OH), garam NH4CN
Sebagai tambahan, larutan non elektrolit memiliki karakteristik sebagai berikut:
- Tidak menghasilkan ion
- Semua dalam bentuk molekul netral dalam larutannya
- Tidak terionisasi Jika dilakukan uji daya hantar listrik: tidak menghasilkan gelembung, dan lampu tidak menyala
Derajat ionisasi = 0 Contohnya adalah larutan gula, larutan alcohol, bensin, larutan urea.
6. Manfaat Larutan Elektrolit
Banyak makanan, minuman, obat-obatan, dan bahan kebutuhan lain yang berupa larutan. Peranan larutan sungguh sangat penting dalam kehidupan kita. Kita ketahui bahwa larutan terdiri atas pelarut dan zat terlarut. Sebagai pelarut, air tergolong pelarut universal, karena air mampu melarutkan banyak zat.
Di alam, sulit dijumpai air yang bersih. Air hujan yang sebenarnya berupa air murni, begitu turun hujan dan melewati udara, maka airpun sambil bergerak turun, melarutkan zat-zat kimia yang ada di udara, debu dan bermacam-macam gas. Sebagai akibatnya, beberapa saat hujan turun, udara makin segar. Kandungan air dalam tubuh kitapun lebih dari 75%. Banyak zat dalam tubuh kita berupa larutan.
Dalam tubuh manusia, elektrolit sangat vital keberadaannya, karena terkait dengan segala mekanisme tubuh termasuk metabolism yaitu sebagai ion pengaktif enzim, pembentuk hormon, melancarkan implus pada syaraf, serta mekanik pada sel sel tubuh, seperti aktivitas permeabilitas membran sel. selain dibutuhkan untuk tubuh, larutan elektrolit juga umum digunakan untuk elektrokimia sperti pengisi pada ACCU, baterai, ataupun jembatan garam.
Elektrolit Utama Tubuh Manusia
Zat terlarut yang ada dalam cairan tubuh terdiri dari elektrolit dan nonelektrolit. Non elektrolit adalah zat terlarut yang tidak terurai dalam larutan dan tidak bermuatan listrik, seperti : protein, urea, glukosa, oksigen, karbon dioksida danasam-asam organik.
Sedangkan elektrolit tubuh mencakup natrium (Na+),kalium (K+), Kalsium (Ca++), magnesium (Mg++), Klorida (Cl-), bikarbonat (HCO3-), fosfat (HPO42-), sulfat (SO42-).Konsenterasi elektrolit dalam cairan tubuh bervariasi pada satu bagian dengan bagian yang lainnya, tetapi meskipun konsenterasi ion pada tiap-tiap bagian berbeda, hukum netralitas listrik menyatakan bahwa jumlah muatan-muatan negatif harus sama dengan jumlah muatan-muatan positif.
Komposisi dari elektrolit-elektrolit tubuh baik pada intarseluler maupun padaplasma terinci dalam tabel di bawah ini :No. Elektrolit Ekstraseluler Intraseluler Plasma Interstitial1.
Kation :
- Natrium (Na+) 144,0 mEq 137,0 mEq 10 mEq
- Kalium (K+) 5,0 mEq 4,7 mEq 141 mEq
- Kalsium (Ca++) 2,5 mEq 2,4 mEq 0• Magnesium (Mg ++) 1,5 mEq 1,4 mEq 31 mEq2. Anion : • Klorida (Cl-) 107,0 mEq 112,7 mEq 4 mEq
- Bikarbonat (HCO3-) 27,0 mEq 28,3 mEq 10 mEq
- Fosfat (HPO42-) 2,0 mEq 2,0 mEq 11 mEq
- Sulfat (SO42-) 0,5 mEq 0,5 mEq 1 mEq
- Protein 1,2 mEq 0,2 mEq 4 mEqa.
Kation :
Sodium (Na+) :
- Kation berlebih di ruang ekstraseluler
- Sodium penyeimbang cairan di ruang eesktraseluler
- Sodium adalah komunikasi antara nerves dan musculus
- Membantu proses keseimbangan asam-basa dengan menukar ion hidrigen padaion sodiumdi tubulus ginjal : ion hidrogen di ekresikan
– Sumber : snack, kue, rempah-rempah, daging panggang.
Potassium (K+) :
- Kation berlebih di ruang intraseluler- Menjaga keseimbangan kalium di ruang intrasel
- Mengatur kontrasi (polarissasi dan repolarisasi) dari muscle dan nerves.
– Sumber : Pisang, alpokad, jeruk, tomat, dan kismis.
Calcium (Ca++) :
- Membentuk garam bersama dengan fosfat, carbonat, flouride di dalam tulangdan gigi untuk membuatnya keras dan kuat
- Meningkatkan fungsi syaraf dan muscle
- Meningkatkan efektifitas proses pembekuan darah dengan proses pengaktifan protrombin dan trombin
– Sumber : susu dengan kalsium tinggi, ikan dengan tulang, sayuran, dll.
Anion :
Chloride (Cl -) :
- Kadar berlebih di ruang ekstrasel
- Membantu proses keseimbangan natrium
- Komponen utama dari sekresi kelenjar gaster
– Sumber : garam dapur
Bicarbonat (HCO3 -) :
- Bagian dari bicarbonat buffer sistem
- Bereaksi dengan asam kuat untuk membentuk asam karbonat dan suasanagaram untuk menurunkan PH.
Fosfat ( H2PO4- dan HPO42-) :
- Bagian dari fosfat buffer system
- Berfungsi untuk menjadi energi pad metabolisme sel
- Bersama dengan ion kalsium meningkatkan kekuatan dan kekerasan tulang
- Masuk dalam struktur genetik yaitu : DNA dan RNA.
– Sumber : Pisang, alpokad, jeruk, tomat, dan kismis.
Calcium (Ca++) :
- Membentuk garam bersama dengan fosfat, carbonat, flouride di dalam tulangdan gigi untuk membuatnya keras dan kuat
- Meningkatkan fungsi syaraf dan muscle- Meningkatkan efektifitas proses pembekuan darah dengan proses pengaktifanprotrombin dan trombin
– Sumber : susu dengan kalsium tinggi, ikan dengan tulang, sayuran, dll.
Anion :
Chloride (Cl -) :
- Kadar berlebih di ruang ekstrasel
- Membantu proses keseimbangan natrium
- Komponen utama dari sekresi kelenjar gaster
– Sumber : garam dapur
Bicarbonat (HCO3 -) :
- Bagian dari bicarbonat buffer sistem
- Bereaksi dengan asam kuat untuk membentuk asam karbonat dan suasana garam untuk menurunkan PH.
Fosfat ( H2PO4- dan HPO42-) :
- Bagian dari fosfat buffer system
- Berfungsi untuk menjadi energi pada metabolisme sel
- Bersama dengan ion kalsium meningkatkan kekuatan dan kekerasan tulang
- Masuk dalam struktur genetik yaitu : DNA dan RNA.
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia



