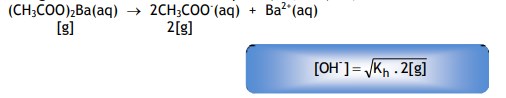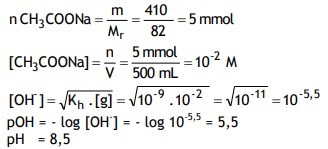Hidrolisis Garam – Jenis Garam yang Terhidrolisis dan Perhitungannya – Garam merupakan senyawa hasil reaksi penetralan antara asam dengan basa. Garam dapat dihasilkan dari asam kuat dengan basa kuat, asam kuat dengan basa lemah, asam lemah dengan basa kuat, atau asam lemah dengan basa lemah.

Di dalam air, garam dapat terurai menjadi ion-ionnya (terionisasi). Ion-ion itu ada yang bereaksi dengan air, yaitu ion-ion yang berasal dari asam lemah atau basa lemah. Reaksi antara air dengan ion-ion yang berasal dari asam lemah atau basa lemah disebut hidrolisis.
A. Pengertian Hidrolisis Garam
Hidrolisis adalah reaksi kimia yang memecah molekul air (H2O) menjadi kation hidrogen (H+) dan anion hidroksida (OH−). Kata “hidrolisis” berasal dari bahasa Yunani hydro “air” + lysis “pemisahan“.
Ketika dalam larutan air terurai menjadi kation hidrogen (H+) dan anion hidroksida (OH−) yang selanjutnya akan bereaksi dengan ion senyawa lain yang menyebabkan tertinggal atau berlebihnya kation hidrogen (H+) dan anion hidroksida (OH−) sehingga larutan bersifat asam atau basa. Jika ion-ion air tidak bereaksi dengan senyawa pada larutan tertentu, larutan tersebut tetap bersifat netral (masih merupakan pH air).
Proses ini biasanya digunakan untuk memecah polimer tertentu, terutama yang dibuat melalui polimerisasi tumbuh bertahap (step-growth polimerization). Hidrolisis berbeda dengan hidrasi. Pada hidrasi, molekul tidak terpecah menjadi dua senyawa baru. Biasa nya hidrolisis terjadi saat proses pencernaan karbohidrat
B. Jenis-Jenis Garam yang Terhidrolisis
Hidrolisis garam di bedakan menjadi 2, yaitu sebagai berikut:
Hidrolisis garam sebagian (parsial)
Hidrolisis garam sebagian adalah reaksi garam dengan air dimana yang bisa bereaksi hanya anion nya saja atau kation nya saja. Garam yang mengalami hidrolisis sebagian yaitu:
- Garam yang terbentuk dari asam lemah dan basa kuat
- Garam yang terbentuk dari asam kuat dan basa lemah.
Hidrolisis garam total
Hidrolisis garam total adalah reaksi garam dengan air dimana semua ion garam dapat bereaksi dengan air, baik kation maupun anion nya. Garam yang mengalami hidrolisis total, yaitu garam yang terbentuk dari asam lemah dan basa lemah.
Baca Juga : 40+ Soal Hidrolisis Garam Pilihan Ganda [+ Pembahasan Lengkap]
1. Garam yang berasal dari asam kuat dan basa kuat
Garam seperti NaCl yang dapat terbentuk dari reaksi basa kuat (NaOH) dan asam kuat (HCl) tidak dapat terhidrolisis sehingga larutannya bersifat netral. Anion Cl− merupakan basa konjugasi yang sangat lemah karena berasal dari asam kuat sehingga cenderung tidak dapat menarik proton.
Kation Na+ tidak terhidrolisis, sebagaimana di dalam air Na+ hanya akan terhidrasi (dikelilingi oleh molekul-molekul H2O). Oleh karena densitas muatannya yang rendah, kemampuan kation Na+ mempolarisasi molekul-molekul H2O di sekitarnya untuk melepas proton dapat diabaikan. Akibatnya, kation Na+ cenderung tidak mempengaruhi keasaman larutan.
- Anion-anion basa konjugasi dari asam kuat yang tidak terhidrolisis, antara lain Cl−, Br−, I−, NO3−, dan ClO4−.
- Kation-kation dari basa kuat yang tidak terhidrolisis, antara lain kation-kation logam golongan IA dan IIA (Li+, Na+, K+, Mg2+, Ca2+), kecuali Be2+.
Larutan garam dari asam kuat dan basa kuat umumnya tidak mengubah perbandingan konsentrasi H+ dan OH− dalam air. Oleh karena itu, larutannya bersifat netral (pH = 7).
2. Garam yang Berasal dari Basa Lemah dan Asam Kuat
Garam seperti NH4Cl yang dapat terbentuk dari reaksi asam kuat (HCl) dan basa lemah (NH3) akan mengalami hidrolisis kation yang berasal dari basa lemah sehingga larutannya bersifat asam. Anion Cl− tidak terhidrolisis karena merupakan basa konjugasi yang sangat lemah.
Kation NH4+ dapat terhidrolisis karena merupakan asam konjugasi lemah yang berasal dari basa lemah sehingga dapat mendonorkan proton (H+) kepada H2O dan membentuk ion hidronium (H3O+).
Kation-kation yang dapat terhidrolisis meliputi:
- kation asam konjugasi dari basa lemah, seperti NH4+, CH3NH3+, C6H5NH3+, dan C5H5NH+;
- kation logam dengan densitas muatan tinggi, seperti Fe3+, Cr3+, Al3+, Cu2+, dan Ni2+.
Simpelnya :
Asam Kuat + Basa Lemah → menghasilkan garam yang bersifat asam
Sudah Pasti hasilnya bersifat Asam
Contoh :
3. Garam yang Berasal dari Asam Lemah dan Basa Kuat
Asam Lemah + Basa Kuat → menghasilkan garam yang bersifat basa
Sudah Pasti hasilnya bersifat Basa
Garam seperti KCN yang dapat terbentuk dari reaksi asam lemah (HCN) dan basa kuat (KOH) akan mengalami hidrolisis anion yang berasal dari asam lemah sehingga larutannya bersifat basa.
Kation K+ tidak terhidrolisis dan juga kation K+ yang terhidrasi memiliki densitas muatan yang rendah sehingga cenderung tidak mempengaruhi keasaman larutan. Anion CN− dapat terhidrolisis karena merupakan basa konjugasi lemah yang berasal dari asam lemah sehingga dapat menarik proton (H+) dari H2O dan membentuk ion hidroksida (OH−).
Contoh :
4. Garam yang Berasal dari Asam Lemah dan Basa Lemah
Asam Lemah + Basa Lemah → Garam Bersifat???? Asam/Basa/Netral??
Belum Pasti hasilnya apakah bersifat Asam atau basa ataupun netral.
Contoh :
Karena kation dan anion yang dihasilkan berasal dari asam lemah dan basa lemah, maka kedua ion tersebut mengalami hidrolisis sempuran/hidrolisis total.
C. Perhitungan [H+] dan [OH-] Larutan Garam
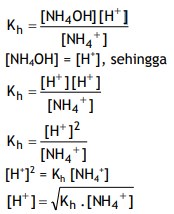
1. Penentuan [H+ ] Larutan Garam yang Bersifat Asam (Asam Kuat + Basa Lemah)
Contoh larutan garam yang bersifat asam adalah NH4Cl.
NH4Cl(aq) → NH4+ (aq) + Cl– (aq)
Perhatikan reaksi hidrolisis NH4+ berikut ini :
NH4+ (aq) + H2O(l) → NH4OH(aq) + H+ (aq)
Konstanta kesetimbangan reaksi hidrolisis disebut konstanta hidrolisis yang disingkat Kh.
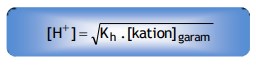
Secara umum rumus tersebut dapat dinyatakan sebagai berikut :
Untuk garam yang memiliki satu kation, maka :
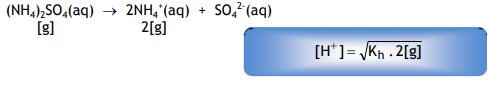
Jika garam memiliki dua kation seperti (NH4)2SO4, maka :
Bagaimanakah dengan rumus Kh untuk garam ini?
2. Penentuan [OH- ] Larutan Garam yang Bersifat Basa (Asam Lemah + Basa Kuat)
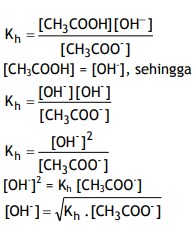
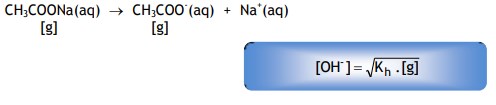
Contoh larutan garam yang bersifat basa adalah CH3COONa.
CH3COONa(aq) → CH3COO– (aq) + Na+ (aq)
Perhatikan reaksi hidrolisis CH3COO– berikut ini :
CH3COO– (aq) + H2O(l) CH3COOH(aq) + OH‑ (aq)
Secara umum rumus tersebut dapat dinyatakan sebagai berikut :
Untuk garam yang memiliki satu kation, maka :
Jika garam memiliki dua kation seperti (CH3COO)2Ba, maka :
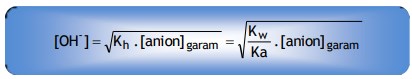
Rumus hidrolisis garam yang bersifat basa adalah :
Untuk garam yang memiliki satu kation berlaku :
Untuk garam yang memiliki dua kation berlaku :
Contoh Soal
Jika 410 mg garam CH3COONa (Mr=82) dilarutkan dalam air hingga volume 500 mL, dan tetapan hidrolisis=10-9 , tentukanlah pH larutan garam!
Penyelesaian
Contoh Soal
Jika 100 mL NH4OH 0,4 M direaksikan dengan 100 mL larutan HCl 0,4 M, Kb NH4OH = 2×10-5 , tentukan pH campuran setelah bereaksi!
Penyelesaian
3. Penentuan [H+ ] Garam yang Berasal dari Asam Lemah dan Basa Lemah
Contoh garam yang berasal dari asam lemah dan basa lemah adalah CH3COONH4
Perhatikanlah reaksi ionisasi berikut!
CH3COONH4(aq) → CH3COO‑ (aq) + NH4+ (aq)
Reaksi hidrolisis:
Maka :
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia