Sifat-sifat, Pembuatan, dan Kegunaan Senyawa turunan Alkana – Alkana (juga disebut dengan parafin) adalah senyawa kimia hidrokarbon jenuh asiklis. Alkana termasuk senyawa alifatik. Dengan kata lain, alkana adalah sebuah rantai karbon panjang dengan ikatan-ikatan tunggal. Rumus umum untuk alkana adalah CnH2n+2.
Sebelumnya kita sudah membahas tentang Senyawa Turunan Alkana – Gugus Fungsi, Tata nama dan Keisomeran, maka berikut ini materi lanjutan tentang senyawa turunan alkana.
Penggunaan alkana sudah dapat diketahui dengan baik oleh manusia. Penggunaan alkana biasanya dikelompokkan berdasarkan jumlah atom karbonnya. Empat alkana pertama digunakan pada umumnya untuk keperluan memasak dan pemanasan, di beberapa negara juga sebagai sumber pembangkit listrik.
Metana dan etana adalah komponen utama pada gas alam dan biasanya diangkut dalam bentuk cairan, dengan cara dikompresi terlebih dahulu dan gas didinginkan.
Baca Juga : 50+ Soal Senyawa Turunan Alkana (Karbon) Pilihan Ganda [+Pembahasan]
Berikut ini Sifat-sifat, Pembuatan, dan Kegunaan Senyawa turunan Alkana.
1. Alkohol
A. sifat sifat alkohol
alkohol mempunyai ikatan hidrogen.
- Semakin besar masa molekul alkohol, titik didihnya semakin tinggi.
- Alkohol mudah larut dalam air
Dapat mengalami reaksi reaksi berikut :
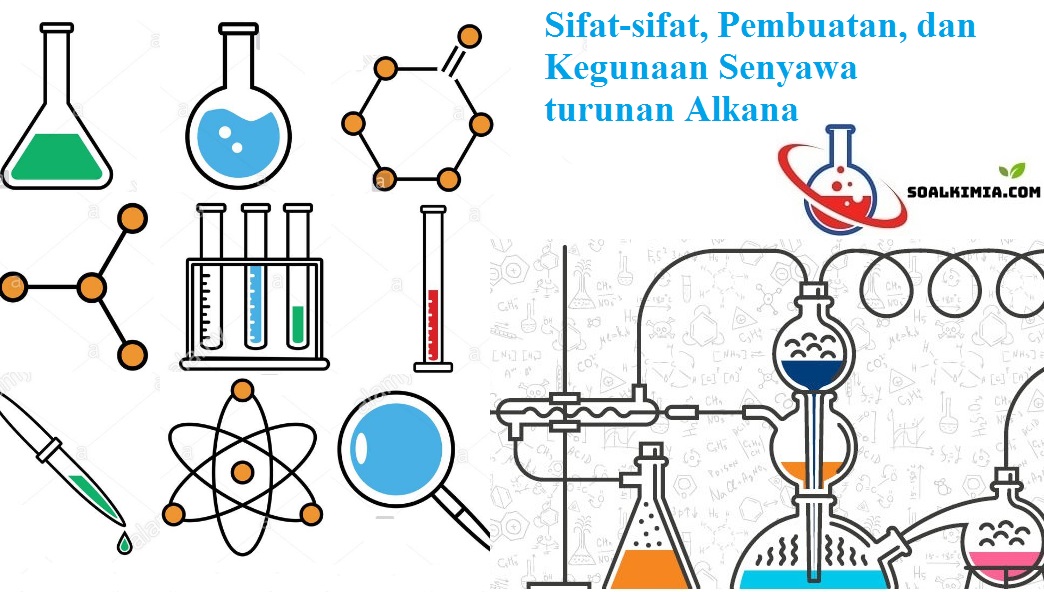
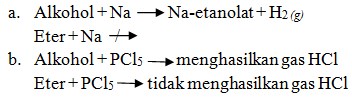
1) Bereaksi dengan logam Na, menghasilkan natrium etanolat.
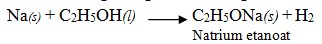
2) Dapat diestifikasi dengan asam, menghasilkan ester.
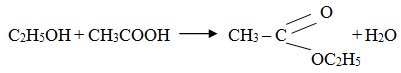
3) Dapat dioksidasi
- Oksidasi alkohol primer menghasilkan aldehid dan asam karboksilat.
- Oksidasi alkohal sekunder menghasilkan keton.
4) Mengalami reaksi dehitrasi
Apabila alkohol dipanaskan dengan asam kuat, akan terjadi suatu alkena dan air.
5) Bereaksi dengan hidrogen halida
Reaksi antara alkohol dengan hidrogen halida menghasilkan halo alkana dan air.
B. Pembuatan Alkohol
- Hidrasi alkena dengan katalis asam menghasilkan etanol.
- Metanol dibuat dari gas alam (metana) dengan H2O dan gas H2.
- Fermentasi karbohidrat dengan bantuan ragi menghasilkan etanol.
- Mengalami pereaksi Grignard..
C. kegunaan alkohol
metanol
- sebagai pelarut, bahan baku pembuatan formaldehid (untuk membuat polimer), dan sebagai campuran bahan bakar bensin.
- sebagai bahan bakar
- Metanol jika dibakar akan menghasilkan karbondioksida dan air.
2CH3OH + 3O2 → 2CO2 + 4H2O
- Sebagai sebuah stok industri
etanol
- sebagai pembersih luka dan anti septik.
- sebagai spirit (minuman keras) bermetil yang diproduksi dalam skala industri.
- sebagai bahan bakar “gasohol” adalah sebuah petrol yang mengandung sekitar 10-20% etanol.
- sebagai pelarut
Contoh etanol digunakan sebagai pelarut pada berbagai parfum dan kosmetik.
- etilen glikol, digunakan sebagai zat anti beku pada radiator,bahan baku serat sintetis seperti daktron,dan bahan pelunak atau pelembut.
- gliserol, digunakan pelembab dan pelembut pada lision dan berbagai kosmetik, pelembut pada tembaku dan obat-obatan, sebagai bahan pembuat nitro gliserin yang digunakan sebagai bahan peledak.
- propan – 2ol banyak digunakan sebagai pelarut.
2. Eter
A. sifat-sifat eter
- merupakan cairan yang mudah menguap dan mudah terbakar
- titik didih rendah, lebih rendah daripada alkohol dengan massa molekul yang sama.
- sedikit larut dalam air
- melarutkan senyawa-senyawa kovalen
- bersifat anestetik
- tidak reaktif, tidak dapat dioksidasi, direduksi, dieleminasi, atau direaksikan dengan basa, tetapi dapat disubstitusikan dengan asam kuat.
B. Pembuatan eter
1) Reaksi dengan asam sulfat dan etanol menghasilkan dietil eter dan etil hidrogen sulfat sebagai zat antara.
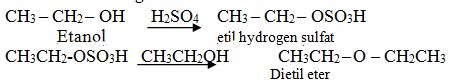
2) Sintesis willianson
Sintesis ini terjadi antara alkil halida dengan alkoksida.
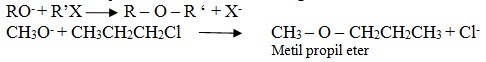
C. Kegunaan Eter
Digunaan sebagai pelarut dan obat anestesi. Etil eter yang diberikan melalui pernapasan sebagai abat bius. contoh : klorofom dan siklopropana. Metil-tersierbutil eter (MTBE) digunakan sebagai zat aditif pada bensin untuk menaikkan bilangan oktan bensin.
Perbedaan alkohol dan eter ditunjukkan melalui reaksi dengan logam natrium fosfor pentaklorida (PCl5).
3. Aldehid
A. Sifat-sifat Aldehid
- Merupakan senyawa polar ;
- Mudah larut dalam air ;
- Melarutkan senyawa polar dan nonpolar ;
- Tidak mempunyai ikatan hidrogen ;
- Tidik didihnya lebih tinggi jika dibandingkan dengan senyawa karbon yang massa relatifnya hampir sama.
Dapat mengalami reaksi berikut :
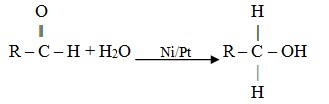
Hidrogenasi
Aldehid dapat mengadisi hidrogen menjadi alkohol primer.
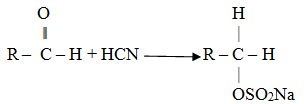
Adisi NaHSO3
Adisi aldehid dengan natrium bisulfit menghasilkan senyawa padat dan sukar larut.
Adisi hidrogen sianida, menghasilkan sianohidral
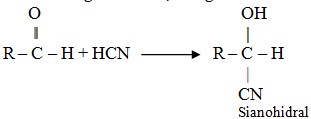
Oksidasi pada aldehid
Dapat dioksidasi dengan pereaksi Fehling dan Tollens, membentuk asam karboksilat.
- Oksidasi dengan pereaksi fehling
Menghasilkan endapan merah bata. Larutan fehling A merupakan larutan CuSO4, sedangkan fehling B merupakan larutan kalium natrium tartat dalam NaOH.
- Oksidasi dengan pereaksi Tollens
Merupakan larutanAgNO3 dicampur dengan larutan amonia berlebih sehingga dalam larutan mengandung ion Ag[NH3]2+. Menghasilkan endapan perak yang menempel pada dinding tabung reaksi dan membentuk cermin. Endapan ini disebut dengan cermin perak.
B. Pembuatan Aldehid
Oksidasi alkohol primer
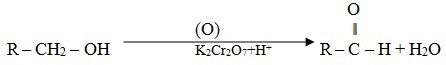
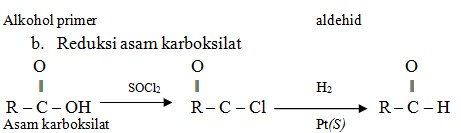
Reduksi asam karboksilat
C. Kegunaan Aldehid
Aldehid yang banyak digunakan yaitu formaldehid. Formaldehid untuk membuat formalin. Formalin digunakan untuk pengawet mayat dan spesi biologi, formaldehid juga digunakan sebagai pembuatan plastik tahan panas.
4. Keton
A. Sifat-sifat keton
- Merupakan senyawa polar
- Larut dalam air
- Tidak mempunyai ikatan hidrogen
- Titik didih keton lebih tinggi dibandingkan hidrokarbon lain dengan massa molekul relatif hampir sama.
Mengalami reaksi berikut :
- Adisi hidrogen, menghasilkan alkohol.
- Adisi HCN, menghasilkan sianohidral.
- Halogenasi .
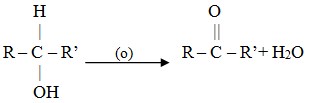
B. Pembuatan keton
Dari oksidasi alkohol sekunder
Distilasi kering garam alkali atau alkali tanah karboksilat
C. Kegunaan keton
Paling banyak digunakan yaitu aseton atau propanon, digunakan sebagai pelarut senyawa-senyawa nonpolar.
5. Asam Karboksilat
A. Sifat-sifat asam karboksilat
- Merupakan senyawa polar.
- Senyawa dengan atom C1 – C4 mudah larut dalam air, semakin banyak cabang kelarutannya dalam air berkurang.
- Titik didih tinggi karena mempunyai ikatan hidrogen.
Mengalami reaksi-reaksi berikut:
- Reaksi dengan logam, garam karbonat, dan basa alkali.
- Reaksi esterifikasi
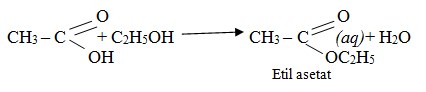
B. Pembuatan asam karboksilat
- Oksidasi alkohol primer
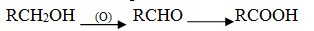
- Hidrolisis senyawa alkana nitril pada suhu tinggi dan asam kuat.
- Hidrolisi gas asetilen dilanjutkan oksidasi diudara
- Mereaksikan gas karbon monoksida dengan larutan NaOH pada tekanan tinggi.
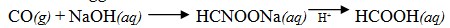
- Oksidasi keton
C. Kegunaan asam karboksilat
Asam karboksilat yang banyak digunakan dalam kehidupan sehari-hari yaitu:
- Asam format, digunakan untuk penyamakan kulit, industri tekstil, dan pengumpulan lateks diperkebunan karet.
- Asam asetat, digunakan sebagai pelarut, dan sintesis hasil industri serat dan plastik.
- Asam oksalat, digunakan untuk penghilang karat dan pereaksi pada pembuatan zat warna.
- Asam tartat, digunakan untuk penyamakan, fotografi dan keramik.
6. Ester
A. Sifat-sifat ester
- Mudah menguap.
- Sedikit larut dalam air.
- Semakin besar massa molekul relatifnya, semakin tinggi titik didihnya.
Dapat mengalami reaksi-reaksi berikut:
- Reaksi hidrolisis ,Terbentuk reaksi kesetimbangan antara asam karboksilat dengan alkohol.
- Hidrolisis dengan basa, Menghasilkan suatu garam dan alkohol.
- Reaksi dengan alkohol, Menghasilkan ester lain dan alkohol lain.
- Dapat direduksi menghasilkan alkohol.
- Bereaksi dengan pereaksi Grignard menghasilkan alkohol.
B. Pembuatan ester
Ester dibuat dari reaksi antara asam karboksilat dengan alkohol, reaksi ini disebut esterifikasi.
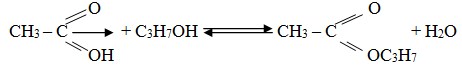
C. Kegunaan ester
Senyawa-senyawa ester banyak digunakan sebagai esens karena mempunyai aroma khas, antara lain :
| No | Ester | Aroma |
| 1 | Etil butirat | Nanas |
| 2 | Metil butirat | Apel |
| 3 | Etil format | Rum |
| 4 | Propil asetat | Pir |
| 5 | Isopentil asetat | Pisang |
| 6 | N-oktil asetat | Jeruk manis |
| 7 | Metil salisilat | Saesaparila |
7. HaloAlkana
Senyawa halo alkana banyak digunakan dalam kehidupan sehari-hari diantaranya:
Kloroform (CHCl3)
Kloroform diperoleh dengan mereaksikan etanol dengan Cl2 dan KOH atau kapur klor. Cl2 berfungsi untuk mengoksidasi etanol menjadi etanal. Etanal dengan Cl2 membentuk trikloro etanal (kloral). Dalam basa kloral diubah menjadi kalium metanoat dan kloroform.
Kloroform bersifat anestesi sehingga dimanfaatkan dalam bidang kedokteran sebagai obat bius. Kloroform sebagai obat bius dinyatakan tidak aman karena mengganggu fungsi hati, sehingga diganti dengan senyawa 2-bromo-2-kloro-1,1,1-trifluoro etana atau disebut senyawa haloetana. Rumus strukturnya yaitu:
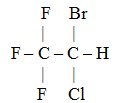
Iodoform (CHI3)
Merupakan kristal padat berwarna kuning dan berbau khas, digunakan dibidang kedokteran sebagai antiseptik.
Karbon Tetraklorida (CCl4)
Merupakan zat cair yang tidak berwarna dan lebih berat dari air. Uap CCl4 tidak mudah terbakar dan noneksplosif. Senyawa CCl4 dibuat dengan mereaksikan kloroform (CHCl3) dengan Cl2.

Dalam rumah tangga CCl4 digunakan untuk menghilangkan noda-noda minyak atau lemak dipakaian, digunakan juga sebagai bahan pemadam kebakaran dan pelarut lemak, lilin, damar dan protein.
Freon (CCl2F2)
Freon merupakan senyawa halo alkana yang sangat stabil, tidak berbau, mudah menguap, tidak mudah terbakar dan memounyai toksisitas rendah. Kegunaan freon adalah sebagai berikut :
- Pelarut lemak, minyak dan damar.
- Bahan pendingin pada freezer dan AC, karena mempunyai titik didih – 30oC
- Sebagai aerosol pada hair spray dan body spray.
Penggunaan freon yang berlebihan dapat merusak lapisan ozon dikarenakan atom-atom klorin yang dibebaskan dari penguraian freon dapat bereaksi dengan ozon.
Fosgen (COCl2)
Fosgen merupakan gas tidak berwarna dan sangat beracun. Fosgen dibuat dengan mereaksikan gas klorin dengan CO dan dialirkan melalui arang tulang.
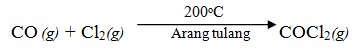
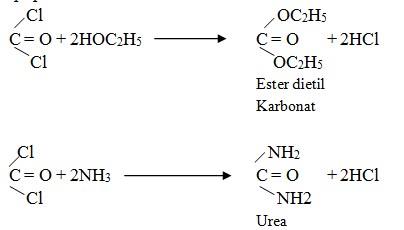
Reaksi antara gas fosgen dengan etanol menghasilkan ester dietil karbonat sementara reaksi gas fosgen dengan amonia menghasilkan urea yang banyak digunakan sebagai pupuk.
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia



