Contoh Soal Unsur Transisi Periode 4 dan Kunci Jawaban beserta Pembahasan – Unsur periode 4 (Period 4 element) merupakan unsur-unsur kimia pada baris (atau periode) keempat tabel periodik. Tabel periodik disusun berdasarkan baris untuk menggambarkan tren keberulangan (periodik) perilaku kimia unsur-unsur seiring dengan kenaikan nomor atom: baris baru dimulai ketika perilaku kimia mulai berulang, artinya bahwa unsur-unsur dengan perilaku yang sama jatuh pada kolom yang sama.
Unsur transisi periode 4, terdiri dari yaitu :
- scandium (Sc)
- titanium (Ti)
- vanadium (V)
- krom (Cr)
- mangan (Mn)
- besi (Fe)
- kobalt (Co)
- nikel (Ni)
- tembaga (Cu) dan
- seng (Zn)
Inilah Soal Unsur Transisi Periode keempat pilihan ganda dengan kunci jawaban lengkap dengan pembahasan yang telah soalkimia.com kumpulkan dari berbagai penerbit buku untuk siswa pelajari agar lebih mudah memahami materi unsur transisi periode 4.
Dalam membantu meningkatkan mutu pendidikan di indonesia kami akan berkontribusi membagikan soal – soal terkait materi sains untuk membantu siswa dalam proses belajar.
1 – 15 Soal Unsur Transisi Periode 4 dan Jawaban beserta pembahasan
1. Beberapa sifat unsur sebagai berikut :
- (1) membentuk senyawa berwarna
- (2) titik leburnya rendah
- (3) dapat membentuk ion kompleks
- (4) diamagnetic
- (5) mempunyai berbagai macam bilangan oksidasi
Sifat unsur transisi periode keempat ditunjukkan oleh….
a. 1,3 & 5
b. 1,2 & 3
c. 4 & 5
d. 2,4 & 5
e. 3, 4 & 5
Jawaban : A
Pembahasan:
Unsur-unsur transisi periode keempat mempunyai titik leleh dan titik didih yang tinggi, di sebabkan karena:
- rapatannya tinggi, menunjukkan tingkat kepadatan antara atom-atom logam sangat tinggi
- jari-jari atom unsur yang relative pendek, memungkinkan ikatan antara logam sangat kuat, yang dikenal dengan ikatan logam.
Sifat kemagnetan unsur transisi ada tiga, yaitu: paramagnetic, diamagnetic dan feromagnetik. Adanya electron-elektron yang tidak berpasangan pada orbital menyebabkan unsur-unsur transisi bersifat paramagnetic.
Paramagnetik adalah sifat dari suatu unsur yang dapat ditarik oleh medan magnet. Makin banyak jumlah electron yang tak berpasangan, makin kuat sifat paramagnetic unsur tersebut. Diamagnetik adalah zat itu ditolak oleh medan magnet, sifat ini dimiliki oleh atom molekul atau ion yang seluruh electron pada orbitnya berpasangan. Dan feromagnetik yaitu ditarik sangat kuat kedalam medan magnet.
Senyawa unsur-unsur transisi pada umumnya berwarna
Contoh:
Unsur-unsur transisi periode keempat merupakan unsur logam. Secara umum nilangan oksidasinya selalu positif. Bilangan oksidasi unsur-unsur transisi periode keempat sebagai berikut:
- Kebanyakan memiliki bilangan oksidasi +2 atau +3 atau keduanya
- Apabila unsur-unsur logam transisi berikatan dengan oksigen, unsur-unsur tersebut menunjukkan variasi bilangan oksidasi karena unsur-unsur transisi dan oksigen mempunyai keelektronegatifan yang tinggi.
2. Suatu unsur transisi periode keempat mempunyai sifat-sifat sebagai berikut.
- (1) bilangan oksida +3 dan +6
- (2) jika bilangan oksidanya +3 dalam air berwarna biru atau hijau
- (3) jika bilangan oksidasinya +6 dalam air berwarna kuning atau jingga
- (4) larutan kuning jika ditambanh atom akan bersifat oksidator an berubah menjadi jingga
Unsur tersebut adalah….
a. Cu
b.Cr
c. Ni
d. Co
e. Zn
Jawaban : B
Pembahasan:
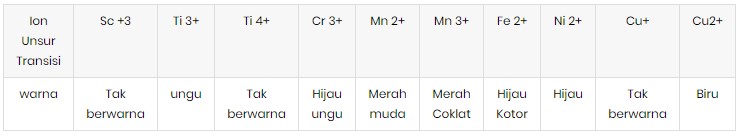
Warna dari senyawa unsur transisi tergantung pada banyak dan jenis ionnya atau molekul lain yang terikat atom lain. Warna-warna dari ion unsur transisi periode keempat yang sesuai dengan bilangan oksidasinya.
| Unsur | Biloks | Warna |
| Sc | +3 | Tidak berwarna |
| Ti | +2
+3 +4 | Ungu
Hijau Tidak berwarna |
| V | +2
+3 +4 +5 | Ungu
Hijau Biru Merah |
| Cr | +3
+6 +6 | Hijau
Kuning Jingga |
| Mn | +2
+3 +6 +7 | Merah Muda
Merah Coklat Hijau Cokelat Ungu |
| Fe | +2
+3 | Hijau
Jingga |
| Co | +2
+3 | Merah Muda
Biru |
| Ni | +2
+3 | Hijau
Merah |
| Cu | +1
+2 | Tidak berwarna
Biru |
| Zn | +2 | Tidak berwarna |
3. Senyawa unsur-unsur transisi periode keempat pada umumnya berwarna. Hal ini disebabkan karena….
a. Orbital d-nya terisi penuh
b. orbital d-nya tidak terisi
c. pengisisan terakhir pada orbital d
d. bersifat paramagnetic
e. Elektron dalam keadaan berpasangan
Jawaban: C
Pembahasan :
Hal yang mempengaruhi warna ion transisi dalam senyawa adalah subkulit d. Subkulit d memiliki 5 orbital yang masing-masing memiliki tingkat energi yang sama. Apabila ion-ion unsur transisi berikatan dengan unsur ion lain maka muatan listrik anion tersebut akan mempengaruhi 5 orbital d, sehingga terjadi perbedaan tingkat energi antara orbital-orbital d.
Elektron-elektron pada orbital d dapat mengalami perpindahan ke tingkat energi yang lebih tinggi, dengan cara menyerap energi tampak. Besarnya energi yang diserap tergantung jenis atom pusat dan anionnya. Apabila semua energi cahaya tampak diserap maka senyawa tersebut tidak berwarna. Karena orbital d terisi penuh electron atau kosong, maka senyawanya atau ionnya tidak berwarna.
Apabila suatu zat menyerap energi cahaya tampak dengan panjang gelombang tertentu, zat tersebut akan meneruskan cahaya tampak yang tidak diserap mata, sehingga zat akan tampak berwarna sesuai dengan warna cahaya yang tidak diserap.
4. Nama mineral yang mengandung mangan adalah….
a. bauksit
b. kobaltit
c. pirolusit
d. kriolit
e. pirit
Jawaban : C
Pembahasan :
Bijih mangan yang utama adalah pirolusit (MnO2). Jika pirit adalah mineral yang mengandung besi (FeS2), kobalt di alam diperoleh sebagai bijih smaltit (CoAs2) dan kobaltit (CoAsS)
5. Beberapa reaksi kimia sebagai berikut:
Reaksi yang terjadi pada peleburan besi pada tanur tinggi adalah….
a. 1,2 & 3
b. 1, 2, & 4
c. 2,3 & 4
d. 2,3 & 5
e. 2,4 & 5
Jawaban : A
Pembahasan:
Pengolahan bijih besi dilakukan di dalam tanur tinggi yang dikenal dengan namablast furnance. Proses pengolahan bjih adalah sebagai berikut.
Bijih besi, kokas dan kapur dimasukkan dari puncak tanur lalu udara panas diembuskan dari bawah. Reaksi yang terjadi pada tanur tinggi adalah sebagai berikut.
“Udara panas yang diembuskan kedalam tanur akan mengalir ke atas dan mengoksidasi kokas dengan reaksi eksoterm menghasilkan gas CO2. Kerika bergerak naik, gas CO2 yang baru terbentuk itu bereaksi lagi dengan kokas yang bergerak turun membentuk CO. Reaksi eksoterm menyebabkan temperature pembakaran di dalam tanur tetap tinggi. Gas CO yang dihasilkan akan mereduksi bijih besi secara bertahap.
Baca Juga : Soal Kimia Unsur
6. V2O5 pada pembuatan H2SO4 menurut proses kontak berfungsi sebagai….
a. oksidator
b. reduktor
c. reactor
d. katalisator
e. reaktan
Jawaban : D
Pembahasan:
Cara paling murah membuat asam sulfat, yaitu dengan proses kontak. Sebagai bahan utamanya digunakan sulfur, udara dan air. Pertama kali yang dilakukan adalah sulfur padat dibakar dengan oksigen dari udara untuk menghasilkan SO2. Selanjutnya, campuran gas SO2 dan udara ditambah dengan katalisator V2O5 pada kondisi 500oC dan tekanan 1 atm yang mengakibatkan SO2 akan teroksidasi menjadi SO3 . Gas SO3 yang terbentuk kemudian direaksikan dengan air membentuk H2SO4
7. Berikut ini merupakan fungsi dari unsur transisi periode keempat.
- (1) Bahan pelapis besi
- (2) Penghantar Listrik
- (3) Bahan bangunan
- (4) Bahan penguat
- (5) Bahan agar menjadi bercahaya
Yang merupakan fungsi dari titanium adalah….
a. 1 dan 2
b. 2 dan 3
c. 3 dan 4
d. 4 dan 5
e. 1 dan 5
Jawaban: D
Pembahasan:
Pada unsur-unsur transisi periode keempat, kegunaannya sebagai berikut:
- Titanium digukan untuk campuran bahan agar menjadi lebih kuat dan bercahaya seperti pesawat dan perhiasan
- Vanadium untuk pembuatan katalisator vanadium peroksida
- Kromium untuk bahan pelapis besi dalam baja
- Besi untuk bahan bangunan, bahan pembuatan mesin dan lain-lain
- Tembaga untuk penghantar listrik
- Seng untuk pelapis besi dan baja untuk mencegah terjadinya korosi
- Mangan untuk pembuatan KMnO4
(Tim Masmedia Buana Pustaka. 2016. Kimia untuk SMA/MA Kelas XII. Masmedia: 120)
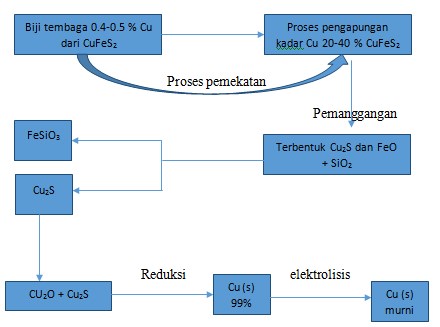
8. Urutan yang benar pada proses pengolahan tembaga dari bijih tembaga adalah….
a. Elektrolisis-reduksi-pemekatan-pemanggangan
b. Reduksi-elektrolsiis-pemanggangan-pemekatan
c. Pemekatan-reduksi-pemanggangan-elektrolisis
d. Pemanganggan-reduksi-pemekatan-elektrolisis
e. pemekatan-pemanggangan-reduksi-elektrolisis
Jawaban : E
Pembahasan:
Pada umumnya bijih tembaga mengandung 0.5 % Cu, karena itu diperlukan pemekatan bijih tembaga. Langkah-langkah pengolahan bijih tembaga adalah seperti skema berikut:
9. Tembaga dibuat dari bijihnya dengan cara pemanggangan, reaksi yang tepat adalah….
Jawaban : A
Pembahasan:
Pada umumnya, bijih tembaga hanya mengandung 0.5 % Cu. Melalui pengapungan dapat dipeoleh biji pekat yang mengandung 20-40% Cu. Bijih pekat itu kemudian dipanggangang untuk mengubah besi sulfide menjadi besi oksida, sedangkan tembaga tetap berupa sulfide.
4 CuFeS2 + 9 O2 → 2 Cu2S + 2 Fe2O3 + 6 SO2
10. Stainless steel adalah baja tahan karat yang merupakan campuran dari….
a. 48% Ni dan 52% Cr
b. 10 % Cr, 35 % Co dan 55 % Fe
c. 9 % Ni, 18 % Cr dan 73 % Fe
d. 20 % Cr dan 80 % Fe
e. 12 % Ni dan 88 % Fe
Jawaban : C
Pembahasan :
Beberapa jenis baja yaitu:
| Nama | Komposisi Logam Campuran |
| Stainless steel | 14-18 % Cr, 7-9 % Ni dan 74 % Fe |
| Baja Mangan | 10-18 % Mn, 1 % C, dan 86 % Fe |
| Baja silicon | 1-5 % Si dan 95 % Fe |
| Baja kobalt | 9 % Co, 1 % C dan 90 % Fe |
| Baja wolfram | 81 % Fe, 18 % , dan 1 % C |
| Baja kromium vanadium | 1-10 % Cr, 0.15 % V dan 89 % Fe |
| Durian | 12-15 % Si dan 85 % Fe |
Baca Juga : Soal Kimia Kelas 10 Semester 1
11. Kuningan Merupakan salah satu jenis aliasi logam….
a. Sn dengan Cu
b. Zn dengan Cu
c. Ag dengan Cu
d. Zn dengan Ni
e. Ni dengan Cr
Jawaban : B
Pembahasan:
Seng juga digunakan sebagai logam paduan, misalnya kuningan yang berasal dari campuran Zn dan Cu yang digunakan untuk membuat alat-alat music dan hiasan
12. Berikut ini yang bukan merupakan mineral yang mengandung bijih besi adalah….
a. Hematit
b. Magnetit
c. Siderit
d. Rutil
e. Pirit
Jawaban : D
Pembahasan:
Hematit : Fe2O3
Siderit : FeCO3
Rutil : TiO2
Magnetit : Fe3O4
Pirit : FeS2
Dari rumus kimia mineral di atas dapat diketahui bahwa mineral yang tidak menganding bijih besi adalah pirit, karena pirit merupakan mineral yang mengandung titanium
13. Perunggu merupakan aliasi antara….
a. Tembaga dengan perak
b. Tembaga dengan timah
c. Tembaga dengan zink
d. Emas dengan perak
e. Tembaga dengan alumunium
Jawaban : B
Pembahasan:
Jenis paduan :
- Perunggu Cu, Zn dan Sn
- Kuningan : Cu dan Zn
- Perak jerman : Cu, Zn, Sn dan Pb
- Emas: Cu, Ag, dan Au
- Monel : Ni dan Cu
14. Alnico merupakan aliasi dari….
a. Al, Ni dan Co
b. Al, N dan Co
c. Al, Ni dan C
d. Al, N, dan C
e. Ag, Ni dan Co
Jawaban : A
Pembahasan :
Beberapa logam campuran dari nikel yang dikenal adalah:
- Monel : Ni dan Cu
- Nikrom : Ni, Fe dan Cr
- Alnico : Ni, Al, Fe dan Co
- Palmitit : Paduan logam nikel
15. Nikelkrom merupakan paduan logam dari….
a. Fe, Cr dan Zn
b. Fe, Co dan Ni
c. Fe, Ni dan Cr
d. Fe, Cr dan Cu
e. Sn, Cu dan Fe
Jawaban : C
Pembahasan :
Beberapa logam campuran dari nikel yang dikenal adalah:
- Monel : Ni dan Cu
- Nikrom : Ni, Fe dan Cr
- Alnico : Ni, Al, Fe dan Co
- Palmitit : Paduan logam nikel
16 – 30 Soal Unsur Transisi Periode 4 Pilihan Ganda Beserta Pembahasan
16. Pernyataan berikut yang bukan merupakan sifat unsur transisi adalah …
a. Bersifat nonlogam
b. Mempunyai beberapa bilangan oksidasi
c. Bersifat paramagnetik
d. Dapat membentuk senyawa kompleks
e. Senyawanya berwarna
Jawaban : A
Pembahasan :
Unsur transisi mempunyai siat-sifat khas yang membedakan dari unsur golongan utama, antara lain :
- Sifat logam, semua unsure transisi tergolong logam dengan titk cair dan titik didih yang relatif tinggi.
- Bersifat paramegnetik (sedikit tertarik ke dalam medan magnet).
- Membentuk senyawa-senyawa yang berwarna.
- Mempunyai beberapa tingkat oksidasi.
- Membentuk berbagai macam ion kompleks.
- Berdaya katalitik, banyak unsur transisi atau senyawanya yang berfungsi sebagai katalis, baik dalam proses industri maupun dalam metabolisme.
17. Unsur-unsur berikut yang termasuk unsur transisi adalah …
a. Sr, Sc dan V
b. Ti, Cr dan Br
c. Fe, Co dan Na
d. Mn, Cu dan Zn
e. Mn, Sc dan Si
Jawaban : D
Pembahasan :
Jadi yang merupakan unsur transisi adalah Mn, Cu dan Zn
18. Berdasarkan perbedaan sifat unsur maka seng dapat digunakan sebagai logam pelindung karena dengan udara …
a. Tidak dapat bereaksi
b. Membentuk seng oksida
c. Membentuk seng karbonat basa
d. Membentuk seng hidroksida
e. Membentuk asam zinkat
Jawaban : B
Pembahasan :
Dalam kehidupan sehari-hari,seng dikenal sebagai salah satu bahan konstruksi bangunan. Seng biasa digunakan sebagai atap rumah. Atap rumah yang terbuat dari seng sebenarnya bukan sepenuhnya berasal dari seng. Seng hanya digunakan sebagai logam pelapis.
Hal ini dikarenakan harga potensial reduksi seng (-0,76) lebih rendah daripada Besi (0,77). Seng yang teroksidasi akan membentuk oksida seng yang bersifat melapisi sehingga oksidasi selanjutnya tidak akan terjadi lagi. Akibatnya besi yang dilapisi seng akan lebih tahan karat dan tahan lama.
19. Pada umumnya unsur transisi bersifat paramagnetik. Hal ini disebabkan oleh …
a. Elektron terluarnya berada pada subkulit d
b. Adanya elektron-elektron tidak berpasangan pada subkulit d
c. Orbital-orbital pada subkulit d terisi penuh elektron
d. Semua unsur transisi bersifat logam
e. Adanya perpindahan elektron pada subkulit d yang tidak penuh
Jawaban : B
Pembahasan :
Setiap atom dan molekul mempunyai sifat magnetik, yaitu paramagnetik, di mana atom, molekul, atau ion sedikit dapat ditarik oleh medan magnet karena ada elektron yang tidak berpasangan pada orbitalnya dan diamagnetik, di mana atom, molekul, atau ion dapat ditolak oleh medan magnet karena seluruh elektron pada orbitnya berpasangan.
Sedangkan pada umumnya unsur-unsur transisi bersifat paramagnetik karena mempunyai elektron yang tidak berpasangan pada orbital-orbital d-nya. Sifat paramagnetik ini akan semakin kuat jika jumlah elektron yang tidak berpasangan pada orbitalnya semakin banyak.
Logam Sc, Ti, V, Cr, dan Mn bersifat paramagnetik, sedangkan Cu dan Zn bersifat diamagnetik. Untuk Fe, Co, dan Ni bersifat feromagnetik, yaitu kondisi yang sama dengan paramagnetik hanya saja dalam keadaan padat.
20. Ditinjau dari konfigurasi elektronnya, Zn dianggap tidak termasuk unsur logam transisi karena Zn …
a. Terletak pada golongan IB
b. Bersifat amfoter
c. Mempunyai subkulit 3d yang terisi penuh
d. Dapat membentuk ion kompleks
e. Mempunyai satu macam bilangan oksidasi
Jawaban : C
Pembahasan :
- Elektron valensi unsur Zn seluruhnya terisi penuh sehingga menyimpang dari kaidah golongan transisi: rata-rata tidak terisi penuh
- Zink mempunyai titik leleh dan didih sangat jatuh dari Cu (tembaga) alias sangat kecil. Maksudnya, rata-rata transisi mempunyai titk leleh dan didih yang tinggi
- Zink tidak berwarna, sekalipun dalam bentuk ion Zn2+, kenyataannya unsur-unsur transisi rata-rata berwarna khas.
- Tingkat oksidasi Zn hanya 1, yaitu biloks +2
- Energi ionisasi Zn sangat tinggi dan mencolok naiknya dari Cu, kenyataannya unsur-unsur transisi periode keempat lainnya mempunyai sifat keelektronegatifan dan keelektropositifan yang rendah
- Konfigurasi elektron Zn stabil, kenyataannya unsur-unsur transisi periode keempat lainnya tidak stabil (tidak penuh)
Baca Juga : Soal Kimia Kelas 10 Semester 1
21. Unsur transisi yang paling banyak terdapat didalam kulit bumi adalah …
a. Krom
b. Mangan
c. Besi
d. Nikel
e. Tembaga
Jawaban : C
Pembahasan :
Besi (Fe) adalah unsur yang cukup melimpah di kerak bumi (sekitar 6,2% massa kerak bumi). Besi jarang ditemukan dalam keadaan bebas di alam. Besi umumnya ditemukan dalam bentuk mineral (bijih besi), seperti hematite (Fe2O3), siderite (FeCO3), dan magnetite (Fe3O4).
22. Dibawah ini yang termasuk macam-macam ligan adalah …
a. Ligan monodentat
b. Ligan okso
c. Ligan nitrat
d. Ligan siano
e. Ligan okasalat
Jawaban : A
Pembahasan:
Yang termasuk macam-macam ligan adalah :
- Ligan monodentat : ligan yang menyumbangkan sepasang elektron pada atom pusat
- Ligan bidentat : ligan yang menyumbangkan dua pasang elektron pada atom pusat
- Ligan polidentat : ligan yang menyumbangkan lebih dari dua pasang elektron pada atom pusat
23. Unsur transisi periode 4 memiliki titik leleh dan titik didih yang tinggi karena, kecuali …
a. Rapatannya tinggi
b. jari-jari atom unsur yang relatif pendek
c. tingkat kepadatan antara atom-atom logam sangat tinggi
d. ikatan antar logam sangat kuat
e. jari-jari atom unsur yang relatif panjang
Jawaban : E
Pembahasan :
Unsur transisi periode 4 mempunyai titik didih dan titik leleh tinggi karena:
- Unsur-unsur transisi periode 4 mempunyai rapatan tinggi yang menunjukkan tingkat kepadatan antara atom-atom logam sangat tinggi
- Unsur-unsur transisi periode 4 mempunyai jari-jari atom unsur yang relatif pendek yang memungkinkan ikatan antaratom logam sangat kuat, yang di kenal dengan ikatan logam
24. Beberapa warna yang tampak pada ion mangan adalah sebagai berikut :
Senyawa mangan berikut yang mempunyai warna hijau adalah …
a. Mn(NO3)2
b. MnO2
c. KMnO4
d. K2MnO4
e. MnCl2
Jawaban : D
Pembahasan :
Karena biloks Mn pada K2MnO4 adalah +6
K2MnO4 = 0
(1 x 2) + Mn + (-2 x 4) = 0
2 + Mn + (-8) = 0
-6 = Mn
Mn = +6
25. Senyawa seng dari unsur transisi tidak berwarna, hal ini disebabkan oleh …
a. Orbital d telah penuh terisi elektron
b. Tidak adanya elektron pada orbital d
c. Orbital d telah terisi elektron setengah penuh
d. Tidak adanya elektron pada orbital s
e. Orbital s telah terisi elektron setengah penuh
Jawaban : A
Pembahasan :
Seng (Zn) melepaskan dua elektronnya pada 4s ketika terkena energy cahaya, sedangkan semua electron pada 3d tetap penuh, sehingga semua gelombang cahaya itu dipantulkan semuanya , sehingga terlihat berwarna putih atau tidak berwarna.
Baca Juga : Soal Kimia Kelas 10 Semester 1
26. Unsur transisi yang bersifat feromagnetik adalah …
a. Sc
b. Ti
c. Cr
d. V
e. Co
Jawaban : E
Pembahasan :
Feromagnetik (Fero : besi : besi itu kuat) = Sifat magnet yang ditarik kuat ke medan magnet. Syaratnya adalah semakin banyaknya elektron tidak berpasangan atau lebih dari satu. Contohnya, Fe, Co, dan Ni.
Sifat Feromagnetik → Sifat ini dimiliki zat yang mempunyai atom-atom paramagnetik yang berada pada jarak sedemikian sehingga interaksi yang terjadi antara atom-atom begitu kuat.
27. Berdasarkan proses goldschmidt, kromium dibuat melalui cara ….
a. Elektrolisis leburan CrCl2
b. Reduksi Cr2O3dengan karbon pijar
c. Reaksi larutan Cr2(SO4)3dengan Ag
d. Reduksi Cr2O3 dengan Al
e. Pemanasan Cr2S3
Jawaban : D
Pembahasan :
Krom (Cr): logam krom dibuat menurut proses goldschmidt dengan jalan mereduksi Cr2O3 dengan logam aluminium. Reaksinya :
Cr2O3 (s) + 2Al(s) → Al2O3(s) + 2Cr(s)
28. Jumlah unsur transisi periode keempat adalah …
a. 6 unsur
b. 8 unsur
c. 10 unsur
d. 12 unsur
e. 14 unsur
Jawaban : C
Pembahasan :
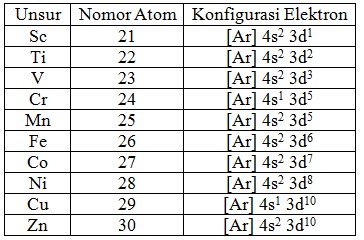
Unsur transisi merupakan kelompok unsur yang terletak pada blok d di dalam sistem periodik. Unsur transisi periode keempat umumnya memiliki elektron valensi pada subkulit 3d yang belum terisi penuh (kecuali unsur Seng (Zn) pada Golongan IIB).
Hal ini menyebabkan unsur transisi periode keempat memiliki beberapa sifat khas yang tidak dimiliki oleh unsur-unsur golongan utama, seperti sifat magnetik, warna ion, aktivitas katalitik, serta kemampuan membentuk senyawa kompleks.
Unsur- unsur transisi pada perioda 4 terdiri atas 10 unsur, yaitu :
29. Nama senyawa kompleks [Ag(CN)2]– …
a. Ion sianoargentat (I)
b. Ion disianoargentat (I)
c. Ion disianida argentat
d. Ion Trisianoargentat
e. Ion disianidaargentum (I)
Jawaban : B
Pembahasan:
Nama ion kompleks [Ag(CN)2]– adalah ion diasianoargentat (I)
Pemberian nama ion kompleks yang bermuatan negatif dimulai dengan nama ligannyakemudian di ikuti oleh nama atom pusat yang di tambah dengan akhiran at dan hanya satu kata. Bilangan oksidasi dari atom pusat di tulis dengan bilangan romawi dalam tanda kurung.
30. Air yang mengandung logam tembaga mempunyai batas maksimum, karena jika telah melebihi batas maksimum dapat menimbulkan dampak negative apabila dikonsumsi. Batas maksimum logam tembaga dalam air adalah….
a. 1 bpj
b. 2 bpj
c. 3 bpj
d. 4 bpj
e. 5 bpj
Jawaban : A
Pembahasan:
Batas maksimum logam tembaga dalam air adalah 1 bpj. Air yang mengandung tembaga dengan kadar melebihi batas maksimum yang diperbolehkan dapat menimbulkan dampak berupa kerongkongan terasa kering, mual-mual, diare yang terus menerus dan iritasi pada lambung. Bpj adalah bagian perjuta
31 – 45 Contoh Soal Transisi Periode 4 dan Pembahasan
31. Cat tembok sering digunakan dalam kehidupan sehari-hari yang mana mengandung senyawa kimia, salah satu diantaranya cat berwarna putih. Senyawa kimia yang terkandung dalam cat putih tersebut adalah….
a. V2O5
b. Cr
c. TiCl3
d. Fe
e. TiO2
Jawaban: E
Pembahasan:
TiO2 (titanium dioksida) adalah pigmen putih, selain itu dapat memberikan sifat cemerlang pada warna lain. Senyawa ini dapat digunakan untuk cat tembok.
V2O5 sebagai katalisator menggunakan proses Kontak, Cr untuk bahan pelapis besi atau alloy dalam baja. Fe untuk bahan bangunan, bahan pembuatan mesin. Dan TiCl3 sebagai katalisator untuk polimerisasi etena menjadi polietena.
32. Konfigurasi elektron yang menyatak unsur transisi adalah …
Jawaban : B
Pembahasan :
Unsur transisi periode keempat adalah unsur yang electron valensinya terletak pada subkulit 3d yang belum terisi penuh kecuali unsur Zn.
33. Data dibawah ini menunjukkan warna beberapa ion unsur transisi
Berdasarkan data diatas, senyawa MnO, TiCl3, CuSO4, dan NiO mempunyai warna berturut-turut …
a. merah coklat – ungu – Tak berwarna – hijau
b. merah muda – Tak berwarna –biru – hijau
c. merah coklat – ungu – biru – hijau
d. merah muda – ungu – Tak berwarna – hijau
e. merah muda – ungu – biru- hijau
Jawaban : E
Pembahasan :
Pada umumnya unsur-unsur transisi periode keempat membentuk senyawa berwarna, baik dalam bentuk padat maupun dalam larutan. warna senyawa dari unsur transisi juga berkaitan dengan adanya subkulit d yang tidak terisi penuh.
MnO adalah senyawa dari Mn+2 maka berwarna merah muda
TiCl3 adalah senyawa dari Ti+3 maka berwarna ungu
CuSO4 adalah senyawa dari Cu+2 maka berwarna biru
NiO adalah senyawa dari Ni+2 maka berwarna hijau
34. Menurut aturan IUPAC, anam yang benar untuk senyawa kompleks [Cr(NH3)5Cl]Cl2 adalah …
a. Pentaaminoklorokromium (III) klorida
b. Kloropentaaminokromium (III) diklorida
c. Krom (III) pentaaminokloroklorida
d. Monoklorokromium (III) pentaaminoklorida
e. dikloropentaaminomonoklorokrom (III)
Jawaban : A
Pembahasan :
Salah satu sifat dari unsur transisi deret pertama yaitu dapat membentuk berbagai macam ion kompleks. Adapun tata cara penamaan senyawa kompleks yaitu :
Nama ion kompleks baik kation maupun anion terdiri ataus dua bagian yang ditulis sdalam satu kata. Bagian pertama menyatakan jumlah dan nama ligan, bagian kedua menyatakan nama ion pusat dan bilangan oksidasinya. Bilangan oksidasi ion pusat ditulis dengan angka Romawi dalam tanda kurung.
- Ligan : NH3 dan Cl-
- Kation kompleks : Cr+2
- Anion Kompleks : Cl-
Jumlah ligan dinyatakan dengan awalan angka dalam bahasa Yunani.
- Ligan NH3 = 5 (Penta)
- Ligan Cl- = 1 (Mono)
Nama ligan yang berupa anion mendapat akhiran “o” sedang ligan-ligan yang berupa molekul netral penamaannya tidak memounyai aturan khusus, jadi dihafalkan saja
Ligan NH3 : Pentaamino
Ligan Cl- : Kloro
Nama ion pusat pada kation kompleks sama dengan nama biasa dari ion pusat itu
Ion pusat Kation : kromium
Ion pusat anion : Diklorida
Nama ion pusat pada anion kompleks harus menggunakan nama IUPAC dan diberi akhiran at
Bila terdapat lebih dari sejenis ligan, maka urutan penulisannya berdasarkan urutan abjad dari nama ligan tsb
Maka nama senyawa tersebut adalah :
pentaaminoklorokromium (III) klorida
35. Rutil, pirolusit, hematit, dan milerit masing-masing rumus molekulnya adalah …
Jawaban : C
Pembahasan :
Berikut nama-nama senyawa pada pilihan diatas :
| Rumus Molekul | Nama senyawa | Rumus Molekul | Nama senyawa |
| Fe2O3 | Hematit | CuFeS2 | Kalkopirit |
| MnO2 | pirolusite | TiO2 | Rutil |
| NiS | milerit | Fe3O4 | Magnetit |
| ZnS | sfalerit | KMnO4 | chameleon |
| CuS | kovelit | ZnCO3 | smithsonite |
Baca Juga : Soal Termokimia
36. Pada proses tanur tinggi, bijih besi harus dicampur dengan kapur. Fungsi kapur adalah …
a. Mengikat SiO2
b. Mengikat oksigen
c. Mengikat kelebihan karbon
d. Menambah ion kalsium
e. Menghasilkan besi murni
Pembahasan :
Adapun bahan baku yang digunakan dalam proses tanur tinggi adalah
- Bujih besi hematit, magentit dengan kandungan SiO2 (lebih kurang 10 %), seedikit senyawa belerang, fosforus, aluminium, mangan
- Batu Kapur (CaCO3) untuk mengikat zat-zat pengotor (SiO2, P4O10, atau oksida amfoter seperti Al2O3)
- Kokas (C) sebagai bahan reduktor. C dapat mereduksi O2 sehingga terbentuk CO2. Gas CO2 yang panas akan naik dan mengoksidasi karbon membentuk gas CO. Gas CO yang terjadi secara bertahap mereduksi bijih besi
- Udara untuk mengoksidasi C sehingga membentuk CO
Jawaban : A
37. Ion Cu2+ dapat membentuk ion kompleks [Cu(NH3)4]2+ maka bilangan koordinasi ion Cu2+ adalah ….
a. 1
b. 2
c. 3
d. 4
e. 5
Pembahasan :
Bilangan koordinasi adalah jumlah ligan sederhana atau jumlah ikatan koordinasi yang dibentuk oleh ion pusat. Seringkali, bilangan koordinasi ion pusat sama dengan dua kali bilangan oksidasinya. Bilangan koordniasi yang umun adalah 2,4 dan 6
Bilangan koordinasi untuk ion pusat Cu2+ yang memiliki bilangan oksidasi +2 adalah 4. Selain melihat bilangan oksidasi lalu dikalikan dua, menenetukan bilangan koordniasi ion pusat dapat juga dilihat dari rumus molekul senyawanya yaitu [Cu(NH3)4]2+ dari rumus senyawa ini bilangan koordinasi berada sesudah tanda kurung ligan.
Jawaban : D
38. Dalam ion kompleks
angka 4 menyatakan …
a. Bilangan koordinasi
b. Valensi (NH3)
c. Jumlah ikatan koordinasi
d. Muatan ion kompleks
e. Banyaknya ikatan ion
Jawaban : A
Pembahasan :
Bilangan koordinasi adalah jumlah ligan sederhana atau jumlah ikatan koordinasi yang dibentuk oleh ion pusat. Seringkali, bilangan koordniasi ion pusat sama dengan dua kali bilangan oksidasinya. Bilangan koordniasi yang umun adalah 2,4 dan 6.
39. Pada proses pengolahan besi dari bijihnya, reaksi akhir untuk mendapatkan logam besi adalah ….
a. Fe3O4 + CO
b. Fe2O3 + CO
c. Fe2O3 + C
d. FeO + C
e. FeO + CO
Jawaban : E
Pembahasan :
Berikut rangkaian reaksi yang terjadi pada pengolahan biji besi dari bijihnya
Udara dialirkan melalui dasar tungku sehingga bereaksi dengan krabon membentuk gas CO2. Reaksi ini bersifat eksoterm sehingga dapat menaikkan temperatur tungku sampai mendekati 1.900°C
C + O2 → CO2
Gas CO2 yang panas naik dan mengoksidasi karbon membentuk gas CO
C + CO2 → 2 CO
Gas CO yang terjadi secara bertahap mereduksi bijih besi
3Fe2O3 + CO → 2Fe3O4 + CO2
(FE3O4 merupakan campuran FeO dan Fe2O3)
Fe3O4 + CO → 3FeO + CO2
FeO + CO → Fe + CO2
Besi yang terbentuk akan turun kebawah dan meleleh didasar tungku
Jawaban : E
40. Sifat unsur transisi periode keempat yang memiliki jari-jari atom yang paling besar adalah….
a. Mn
b. Cr
c. V
d. Ti
e. Sc
Jawaban : E
Pembahasan:
Jari-jari atom dipengaruhi oleh gaya tarik-menarik antara inti dan electron. Pada unsur transisi periode keempat dari Sc ke Ni terjadi penurunan jari-jari atom, karena meski terdapat lebih banyak electron di subkulit 3d, namun electron-elektron ini terikat semakin kuat keinti.
Hal ini dikarenakan muatan inti bertambah positif dari kiri ke kanan.
| Unsur | Sc | Ti | V | Cr | Mn |
| Jari-jari Atom | 1.44 | 1.32 | 1.22 | 1.18 | 1.17 |
Baca Juga : Soal Lipid (Lemak)
41. Unsur transisi periode keempat yang memiliki orbital d nya penuh (3d10) adalah….
a. Cu dan Sc
b. Cu dan Ni
c. Cu dan Zn
d. Zn dan Sn
e. Zn dan Ni
Pembahasan :
Jawaban: C
42. Zat di bawah ini diperlukan untuk pembuatan besi kasar menurut tanur tinggi, kecuali….
a. Fe2O3
b. CaCO3
C. SiO2
d. Udara
e. Kokas
Pembahasan :
Besi yang keluar dari tungku disebut besi kasar dan mengandung 95% Fe, 4% dan sedikit silicon, fosforus, dan belerang. Besi kasar bersifat getas. Pengolahan besi meliputi penyediaan bahan baku, prinsip pengolahan dan proses pengolahan.
Bahan baku
- Bijih besi hematit (Fe2O3) , magnetit (Fe3O4) dengan kandungan SiO2 (10 %) sedikit senyawa belerang, fosforus, alumunium dan mangan.
- Batu kapur (CaCO3) untuk mengikat zat pengotor
- Kokas (C) sebagai bahan reduktor
- Udara untuk mengoksidasi C sehingga membentuk CO
Jawaban : C
43. Berikut ini tabel tentang nama bijih mineral dan unsur ya ng terkandung dalam bijih tersebut :
| No | Nama Bijih | Kandungan Unsur |
| 1 | Bauksit | Titanium |
| 2 | Kalkopirit | Tembaga |
| 3 | Hematit | Besi |
| 4 | Pyrit | Nikel |
| 5 | Pirolusit | Mangan |
Hubungan yuang sesuai antyara bijih dan unsur yang dikandungnya adalah nomor …
a. 1 dan 5
b. 2 dan 3
c. 2 dan 4
d. 2 dan 5
e. 3 dan 5
Pembahasan :
| No | Nama Bijih | Kandungan Unsur |
| 1 | Bauksit | Alumium |
| 2 | Kalkopirit | Besi |
| 3 | Hematit | Besi |
| 4 | Pyrit | Besi |
| 5 | Pirolusit | Mangan |
Jawaban : E
44. Reduktor yang sering digunakan secara besar-besaran unturk mereduksi bijih besi menjadi logamnya adalah …
a. Natrium
b. Hidrogen
c. Aluminium
d. Karbon
e. Platina
Pembahasan :
Adapun bahan baku yang digunakan dalam proses tanur tinggi adalah
- Bujih besi hematit, magentit dengan kandungan SiO2 (lebih kurang 10 %), seedikit senyawa belerang, fosforus, aluminium, mangan
- Batu Kapur (CaCO3) untuk mengikat zat-zat pengotor (SiO2, P4O10, atau oksida amfoter seperti Al2O3)
- Kokas (C) sebagai bahan reduktor. C dapat mereduksi O2 sehingga terbentuk CO2. Gas CO2 yang panas akan naik dan mengoksidasi karbon membentuk gas CO. Gas CO yang terjadi secara bertahap mereduksi bijih besi
Udara dialirkan melalui dasar tungku sehingga bereaksi dengan krabon membentuk gas CO2. Reaksi ini bersifat eksoterm sehingga dapat menaikkan temperatur tungku sampai mendekati 1.900°C
C + O2 → CO2
Gas CO2 yang panas naik dan mengoksidasi karbon membentuk gas CO
C + CO2 → 2 CO
Gas CO yang terjadi secara bertahap mereduksi bijih besi
Udara untuk mengoksidasi C sehingga membentuk CO
Jawaban : D
45. Nama yang benar untuk senyawa kompleks K2PtCl6 adalah …
a. Kalium Kloroplatinat (IV)
b. Kalium heksakloroplatina (IV)
c. Heksakloroplatinat (IV) kalium
d. Kalium heksakloroplatinat (IV)
e. Kalium heksakloriumplatina (IV)
Pembahasan :
Reaksi :
K2PtCl6 → 2K+ + [ PtCl6 ]-2
Salah satu sifat dari unsur transisi deret pertama yaitu dapat membentuk berbagai macam ion kompleks. Adapun tata cara penamaan senyawa kompleks yaitu :
(1.) Nama ion kompleks baik kation maupun anion terdiri atas dua bagian yang ditulis dalam satu kata. Bagian pertama menyatakan jumlah dan nama ligan, bagian kedua menyatakan nama ion pusat dan bilangan oksidasinya. Bilangan oksidasi ion pusat ditulis dengan angka Romawi dalam tanda kurung.
- Ligan : Cl-
- Kation kompleks : K+
(2.) Jumlah ligan dinyatakan dengan awalan angka dalam bahasa Yunani.
- Ligan Cl- = 6 (Heksa)
(3.) Nama ligan yang berupa anion mendapat akhiran “o” sedang ligan-ligan yang berupa molekul netral penamaannya tidak mempunyai aturan khusus, jadi dihafalkan saja
(4.) Nama ion pusat pada kation kompleks sama dengan nama biasa dari ion pusat itu
- Ion pusat Kation : Kalium
(5.) Nama ion pusat pada anion kompleks harus menggunakan nama IUPAC dan diberi akhiran at
(6.) Bila terdapat lebih dari sejenis ligan, maka urutan penulisannya berdasarkan urutan abjad dari nama ligan tsb
Maka nama senyawa tersebut adalah : Kalium Heksakloroplatina (IV)
Jawaban : B
Anda bisa mendownload File soal dalam format .doc agar mudah dibaca dan tertata rapi lengkap dengan peta konsep dan prasyarat materi melalui link berikut ini:
Google Drive | Zippyshare | Mirror
Sudah selesai membaca dan berlatih soal ini ? Ayo lihat dulu Daftar Soal Kimia lainnya



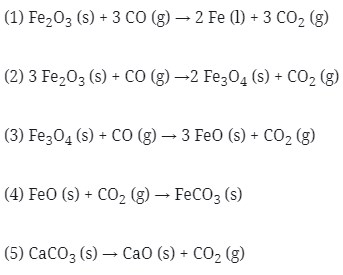








saya masih kesulitan download, krn ada iklannya pak
https://drive.google.com/file/d/1gtPSKfammBLHriaDKzGDfLTBzD_K5ziE/view?usp=sharing