Stoikiometri behubungan dengan hubungan kuantitatif antar unsur dalam satu senyawa dan antar zat dalam suatu reaksi. Istilah itu berasal dari Yunani, yaitu dari kata stoicheion, yang berarti unsur dan mentron yang artinya mengukur.
Dasar dari semua hitungan stoikiometri adalah pengetahuan tentang massa atom dan massa molekul. Oleh karena itu, stoikiometri akan dimulai dengan membahas upaya para ahli dalam penentuan massa atom dan massa molekul.
1. Pengertian Stoikiometri
Stoikiometri berasal dari kata Stoicheion yang berarti unsur dan metrain yang berarti pengukuran. Jadi stoikiometri merupakan aspek kimia yang menyangkut hubungan berbagai komponen dalam reaksi kimia dan hubungan kuantitatif diantara komponen tersebut.
Ilmu kimia adalah ilmu yang berlandaskan eksperimen, dimulai dari pengamatan, kemudian diperoleh data yang selanjutnya didapatkan keteraturan. Keteraturan yang diperoleh secara eksperimen disebut hokum. Didalam ilmu kimia telah ditemukan beberapa hukum dasar atau hukum-hukum pokok ilmu kimia.
2. Hukum-Hukum Dasar Kimia
Ilmu kimia merupakan bagian ilmu pengetahuan alam yang mempelajari materi yang meliputi susunan, sifat, dan parubahan materi serta energi yang menyertai perubahan materi. Penelitian yang cermat terhadap pereaksi dan hasil reaksi telah melahirkan hukum-hukum dasar kimia yang menunjukkan hubungan kuantitatif atau yang disebut stoikiometri.
Stoikiometri berasal dari bahasa Yunani, yaitu stoicheon yang berarti unsur dan metrain yang berarti mengukur. Dengan kata lain, stoikiometri adalah perhitungan kimia yang menyangkut hubungan kuantitatif zat yang terlibat dalam reaksi.
Ada 4 Macam Hukum Dasar kimia yaitu :
- Hukum Kekekalan Massa (Hukum Lavoisier)
- Hukum Proust atau Hukum Perbandingan Tetap
- Hukum Perbandingan Berganda (Hukum Dalton)
- Hukum Perbandingan Volume (Hukum Gaylussac)
Perhitungan Kimia
Pada awal abad ke-19, banyak penelitian dilakukan terhadap sifat gas. Salah seorang peneliti sifat gas yaitu ahli kimia berkebangsaan Prancis yang bernama Joseph Louis Gay Lussac (1778 – 1850). Pada tahun 1808, ia melakukan serangkaian percobaan untuk mengukur volume gas-gas yang bereaksi.
Disimpulkannya bahwa pada temperatur dan tekanan sama, perbandingan volume gas-gas yang bereaksi dan volume gas hasil reaksi merupakan perbandingan bilangan bulat dan sederhana. Temuan Gay Lussac ini dikenal sebagai hukum perbandingan volume.
Tetapi kemudian timbul pertanyaan. Mengapa pada tekanan dan temperatur yang sama perbandingan volume gas yang bereaksi dan hasil reaksi merupakan perbandingan bilangan bulat dan sederhana ? Pertanyaan yang timbul setelah Gay Lussac mengemukakan hukum perbandingan volume dapat dipecahkan oleh seorang ahli fisika Italia yang bernama Amadeo Avogadro pada tahun 1811.
Menurut Avogadro
”Gas-gas yang volumenya sama, jika diukur pada suhu dan tekanan yang sama, akan memiliki jumlah molekul yang sama pula”.
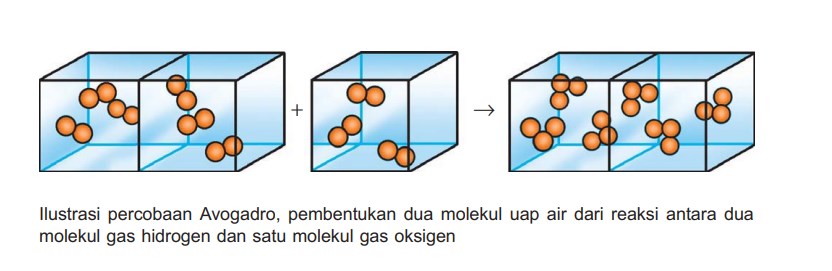
Oleh karena perbandingan volume gas hidrogen, gas oksigen, dan uap air pada reaksi pembentukan uap air = 2 : 1 : 2 maka perbandingan jumlah molekul hidrogen, oksigen, dan uap air juga 2 : 1 : 2. Jumlah atom tiap unsur tidak berkurang atau bertambah dalam reaksi kimia. Oleh karena itu, molekul gas hidrogen dan molekul gas oksigen harus merupakan molekul dwiatom, sedangkan molekul uap air harus merupakan molekul triatom.
Perbandingan volume gas dalam suatu reaksi sesuai dengan koefisien reaksi gas-gas tersebut. Hal ini berarti bahwa, jika volume salah satu gas diketahui, volume gas yang lain dapat ditentukan dengan cara membandingkan koefisien reaksinya
Contoh
Pada reaksi pembentukan uap air.
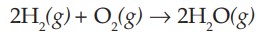
Jika volume gas H2 yang diukur pada suhu 25°C dan tekanan 1 atm sebanyak 10 L volume gas O2 dan H2O pada tekanan dan suhu yang sama dapat ditentukan dengan cara sebagai berikut.
Penyelesaian

3. Massa Atom Relatif dan Massa Molekul Relatif
Setelah ditemukan peralatan yang sangat peka di awal abad XX, para ahli kimia melakukan percobaan tentang massa satu atom. Sebagai contoh, dilakukan percobaan untuk mengukur.
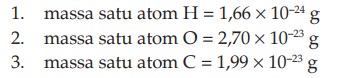
Dari data di atas dapat dilihat bahwa massa satu atom sangat kecil. Para ahli sepakat menggunakan besaran Satuan Massa Atom (sma) atau Atomic Massa Unit (amu) atau biasa disebut juga satuan Dalton. Pada materi struktur atom, Anda telah mempelajari juga bahwa atom sangatlah kecil, oleh karena itu tidak mungkin menimbang atom dengan menggunakan neraca.
A. Massa Atom Relatif (Ar)
Para ahli menggunakan isotop karbon C–12 sebagai standar dengan massa atom relatif sebesar 12. Massa atom relatif menyatakan perbandingan massa rata-rata satu atom suatu unsur terhadap 1:12 massa atom C–12. Atau dapat dituliskan:
1 satuan massa atom (amu) = 1:12 massa 1 atom C–12
Contoh
Massa atom rata-rata oksigen 1,33 kali lebih besar dari pada massa atom karbon –12.
Maka :
Ar O = 1,33 x Ar C–12
= 1,33 x 12
= 15,96
Para ahli membandingkan massa atom yang berbeda-beda, menggunakan skala massa atom relatif dengan lambang ”Ar ”
B. Massa Molekul Relatif (Mr)
Molekul merupakan gabungan dari beberapa unsur dengan perbandingan tertentu. Unsur-unsur yang sama bergabung membentuk molekul unsur, sedangkan unsur-unsur yang berbeda membentuk molekul senyawa. Massa molekul unsur atau senyawa dinyatakan oleh massa molekul (Mr ).
Massa molekul relatif adalah perbandingan massa molekul unsur atau senyawa terhadap 1:12 x massa atom C–12. Secara matematis dapat dinyatakan:

Massa molekul dapat dihitung dengan menjumlahkan Ar dari atom-atom pembentuk molekul tersebut. Mr = ∑ Ar atom penyusun.
Contoh
Diketahui massa atom relatif (Ar ) beberapa unsur sebagai berikut.
Ca = 40
O = 16
H =1
Tentukan massa molekul relatif (Mr) senyawa Ca(OH)2 !
Jawab:
Satu molekul Ca(OH)2 mengandung 1 atom Ca, 2 atom O, dan 2 atom H.
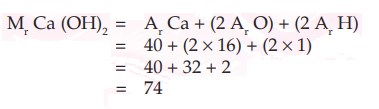
4. Konsep Mol dan Tetapan Avogadro
Apabila Anda mereaksikan satu atom karbon (C) dengan satu molekul oksigen (O2) maka akan terbentuk satu molekul CO2 . Tetapi sebenarnya yang Anda reaksikan bukan satu atom karbon dengan satu molekul oksigen, melainkan sejumlah besar atom karbon dan sejumlah besar molekul oksigen.
Oleh karena jumlah atom atau jumlah molekul yang bereaksi begitu besarnya maka untuk menyatakannya, para ahli kimia menggunakan ”mol” sebagai satuan jumlah partikel (molekul, atom, atau ion).
Satu mol didefinisikan sebagai jumlah zat yang mengandung partikel zat itu sebanyak atom yang terdapat dalam 12,000 g atom karbon –12.
Jadi, dalam satu mol suatu zat terdapat 6,022 x 10²³ partikel. Nilai 6,022 x 10²³ partikel per mol disebut sebagai tetapan Avogadro, dengan lambang L atau N.
Contoh Soal
1. Pada satu molekul air (H2O) terdapat 6,022 x 10–²³ molekul H2O. Ada berapa atom dalam 1 mol air tersebut?
Jawab:

2. Tentukan jumlah atom yang terdapat dalam 0,5 mol belerang!
Jawab:
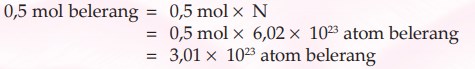
3. Dalam 5 mol asam sulfat (H2SO4 ), tentukan jumlah atom H, S, dan O!
Jawab:
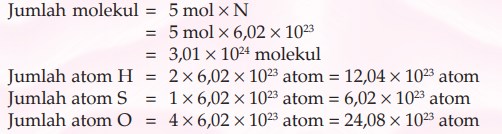
Dari contoh di atas, dapat disimpulkan mengenai hubungan jumlah mol (n) dengan jumlah partikel, yang secara matematik dapat dinyatakan sebagai berikut.
Jumlah partikel = n x N
5. Rumus Empiris Dan Rumus Molekul
Rumus kimia suatu zat dapat menjelaskan atau menyatakan jumlah relative atom yang ada dalam zat itu. Rumus kimia dibedakan menjadi rumus molekul dan rumus empiris.
Rumus empiris adalah rumus yang paling sederhana dari suatu senyawa. Rumus ini hanya menyatakan perbandingan jumlah atom-atom yang terdapat dalam molekul. Rumus empiris suatu senyawa dapat ditentukan apabila diketahui salah satu :
- Massa dan Ar, masing-masing unsurnya
- % massa dan Ar masing-masing unsurnya
- Perbandingan massa dan Ar masing-masing unsurnya
Rumus molekul suatu zat menjelaskan jumlah atom setiap unsur dalam satu molekul zat itu. Bila rumus empirisnya sudah diketahui dan Mr juga diketahui, maka rumus molekulnya dapat ditentukan.
Contoh Soal
Suatu senyawa Hidrokarbon terdiri dari 84% karbon dan 16% hydrogen. Jika diketahui Mr Hidkarbon tersebut adalah 100, tentukan rumus molekul hidrokarbon tersebut.
Penyelesaian :
Dik :
Karbon 84% gram = 84/100 x 100 = 84 gram
Hidrogen 16% gram = 16/100 x 100 = 16 gram
Dit :
Rumus molekul hidrokarbon =…?
Jawab:

6. Kemolaran
Kemolaran adalah suatu cara untuk menyatakan konsentrasi (kepekatan) larutan. Menyatakan jumlah mol zat terlarut dalam tiap liter larutan, atau jumlah mmol zat terlarut dalam tiap mL larutan.
Misalnya :
larutan NaCl 0,2 M artinya, dalam tiap liter larutan terdapat 0,2 mol (= 11,7 gram) NaCl atau dalam tiap mL larutan terdapat 0,2 mmol (= 11,7 mg) NaCl.
Rumus Pengenceran :
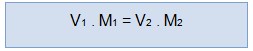
Keterangan
- V1 : Volume sebelum pengenceran (Liter)
- M1 : Molaritas sebelum pengenceran (M)
- V2 : Volume sesudah penegnceran (Liter)
- M2 : Molaritas sesudah pengenceran (M)
Contoh Soal
Larutan NaOH 0,5 M sebanyak 200 mL hendak diencerkan hingga menjadi larutan NaOH 0.2 M. Tentukan volume air yang harus ditambahkan ke dalam larutan tersebut.
Penyelesaian :
Dik =
- M1 NaOH : 0,5 M
- V1 NaOH : 200 mL
- M2 NaOH : 0,2 M
Dit = V2 NaOH : ….?
Jawab :

7. Molalitas
Molalitas menyatakan perbandingan mol zat terlarut dalam kilogram pelarut. Molalitas dinyatakan antara jumlah mol zat terlarut dengan massa dalam kg pelarut. Bagaimana simbol dari molalitas zat? Molalitas disimbolkan dengan (m).

Contoh Soal :
Hitunglah molalitas larutan yg terjadi bila 24 gr kristal MgSO4 dilarutkan dalam 400gr air (Mr MgSO4=120)
Penyelesaian :
Diketahui :
- n = 24/120 mol = 0,2 mol
- P = 400 gr
Ditanya :
m = ….?
Jawab :
m = 0,2 x (1000/400)
= 0,5 molal
8. Fraksi Mol
Fraksi mol merupakan satuan konsentrasi yang menyatakan perbandingan antara jumlah mol salah satu komponen larutan (jumlah mol zat pelarut atau jumlah mol zat terlarut) dengan jumlah mol total larutan. Fraksi mol disimbolkan dengan X.
Misal dalam larutan hanya mengandung 2 komponen, yaitu zat B sebagai zat terlarut dan A sebagai pelarut, maka fraksi mol A disimbolkan XA dan XB untuk fraksi mol zat terlarut atau dengan :

Contoh Soal
Jika didalam zat terlarut dan zat pelarut ada 200 gram air dan dilarutkan 30 gram asam cuka (CH3COOH) fraksi molnya zat terlarut adalah (Ar C = 12, H= 1, O = 16) ….
Penyelesaian
Mr CH3COOH = 60
Mr H2O = 18

Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia




Setujuuuuu, Pak …..