Laju Reaksi – Orde Reaksi, Faktor yang Mempengaruhi, dan Katalis – Reaksi kimia ada yang berlangsung cepat, ada pula yang berlangsung lambat. Kembang api akan menyala dengan cepat dan segera habis setelah kita sulut. Jika kita menyalakan korek api, pentul korek api juga akan cepat habis terbakar lebih cepat dibandingkan dengan batang kayu korek api. Kecepatan dalam suatu reaksi kimia sering disebut “ Laju Reaksi “.

1. Pengertian Laju Reaksi dan Penentuannya
Istilah laju atau kecepatan sering dibicarakan dalam ilmu fisika, pengertian laju dalam reaksi sebenarnya sama dengan laju pada kendaraan yang bergerak, misalnya seseorang mengendarai sepeda motor sejauh 100 km ditempuh dalam waktu 2 jam. Orang tersebut mengendarai sepeda motor dengan kecepatan 50 km/jam.
Kecepatan tersebut dapat diartikan bahwa setiap orang tersebut mengendarai kendaraannya selama 1 jam maka jarak yang ditempuh bertambah 50 km. Pernyataan tersebut juga dapat diartikan bahwa setiap orang tersebut mengendarai sepeda motornya selama 1 jam maka jarak yang harus ditempuh berkurang sejauh 50 km.
Cara menghitung kecepatan demikian ini menghasilkan kecepatan rata-rata, karena selama mengendarai kendaraan mulai dari berangkat sampai tiba ditujuan tidak selalu mengendarai dengan laju 50 km/jam, tetapi ada kalanya berhenti, dipercepat atau diperlambat.
Reaksi kimia menyangkut perubahan dari suatu pereaksi (reaktan) menjadi hasil reaksi atau produk, yang dinyatakan dengan persamaan reaksi :
Reaktan (pereaksi) → produk (hasil reaksi)
Seperti halnya pada contoh di atas, maka laju reaksi dapat dinyatakan sebagai
berkurangnya jumlah reaktan untuk setiap satuan waktu atau bertambahnya jumlah hasil reaksi untuk setiap satuan waktu.
Ukuran jumlah zat dalam reaksi kimia umumnya dinyatakan sebagai konsentrasi molar atau molaritas (M), dengan demikian maka
menyatakan berkurangnya konsentrasi pereaksi atau bertambahnya konsentrasi zat hasil reaksi setiap satu satuan waktu (detik).
Satuan laju suatu reaksi umumnya dinyatakan dalam satuan mol dm-3det-1 atau mol/liter detik . Satuan mol dm-3 atau molaritas ( M ), adalah satuan konsentrasi larutan.
Baca Juga : 60+ Soal Laju Reaksi Pilihan Ganda dan Jawaban [+Pembahasan]
A. Stoikiometri Laju Reaksi
Terdapat hubungan stoikiometri antara laju suatu reaksi yang diukur terhadap berkurangnya konsentrasi pereaksi dan bertambahnya konsentrasi hasil reaksi. Untuk reaksi A → B bila laju suatu reaksi dinyatakan sebagai berkurangnya A setiap satuan waktu – Δ[A]/ Δt akan sama dengan laju suatu reaksi yang dinyatakan berdasar bertambahnya B setiap satuan waktu Δ[B]/Δt sebab setiap sebuah molekul A berkurang maka akan menghasilkan sebuah molekul B.
Untuk reaksi yang memenuhi persamaan reaksi :
2C → D
berarti setiap 2 molekul C yang berkurang setiap satuan waktu akan menghasilkan sebuah molekul D, dengan demikian laju sebuah reaksi yang diukur berdasarkan jumlah D yang dihasilkan akan setara dengan ½ dari laju reaksi yang diukur berdasar berkurangnya C dalam satuan waktu yang sama, atau Δ.

Baca Juga : 60+ Soal Laju Reaksi Pilihan Ganda dan Jawaban [+Pembahasan]
B. Penentuan Laju Reaksi
Penentuan laju suatu reaksi dapat dilakukan dengan cara fiisika atau dengan cara kimia. Dengan cara fisika penentuan konsentrasinya dilakukan secara tidak langsung, yaitu berdasar sifat-sifat fisis campuran yang dipengaruhi oleh konsentrasi campuran, misalnya daya hantar listrik, tekanan (untuk reaksi gas), absorbsi cahaya, dan lain-lainnya. Penentuan secara kimia dilakukan dengan menghentikan reaksi secara tiba-tiba (reaksi dibekukan) setelah selang waktu tertentu, kemudian konsentrasinya ditentukan dengan metode analisa kimia.
Berikut ini contoh penentuan laju suatu reaksi dari reaksi antara larutan Br2 dengan asam formiat pada suhu 25oC yang ditentukan melalui konsentrasi Br2 untuk setiap satuan waktu. Konsentrasi Br2 ditentukan melalui spektrofootometer berdasarkan perubahan warna Br2 yang tersisa. Reaksi yang terjadi adalah :
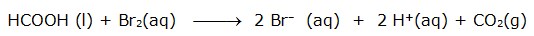
Hasil Pengukuran Laju dalam Reaksi Bromin dengan asam formiat pada 25oC
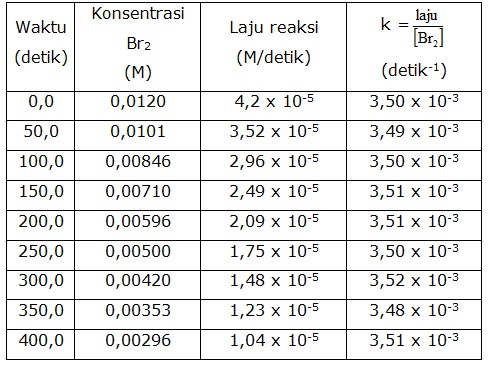
Dengan mengikuti perubahan konsentrasi Br2 dari waktu ke waktu dapat ditentukan laju rata-rata reaksi dalam selang waktu tertentu dengan perhitungan :

Dari kedua perhitungan tersebut menunjukkan bahwa ada perbedaan laju rata-rata reaksi yang dihitung dalam selang waktu yang berbeda. Pendekatan ini tidak akurat sehingga diperlukan cara perhitungan laju suatu reaksi yang berlaku dalam setiap saat, yang dikenal dengan laju sesaat reaksi .
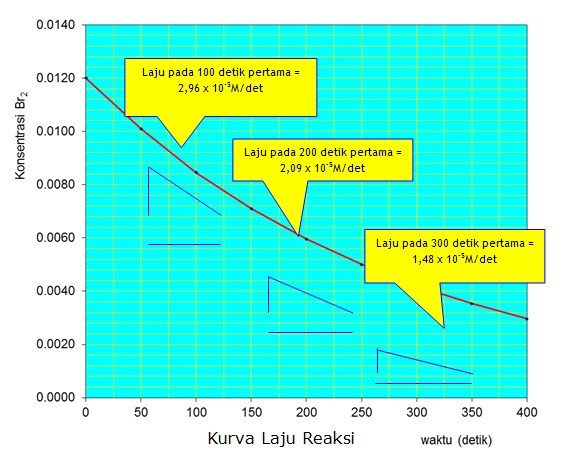
Laju sesaat reaksi dapat ditentukan melalui cara grafik, dimana sebenarnya merupakan gradien dari kurva antara waktu dengan perubahan konsentrasi pada selang waktu tertentu. Oleh karena itu terdapat suatu bilangan tetap yang merupakan angka faktor perkalian terhadap konsnetrasi yang disebut sebagai tetapan laju (k). Dengan demikian maka laju reaksi sesaat secara umum dapat dinyatakan sebagai :
laju reaksi » k [Br2]
2. Hukum Laju Reaksi
Dari percobaan menunjukkan bahwa laju suatu reaksi akan menurun dengan bertambahnya waktu, ini berarti ada hubungan antara konsentrasi zat yang tersisa saat itu dengan laju suatu reaksi. Pada percobaan – percobaan menunjukkan bahwa
“umumnya laju reaksi tergantung pada konsentrasi awal dari zat-zat pereaksi”, pernyataan ini dikenal dengan Hukum atau Persamaan laju reaction.
Secara umum untuk reaksi :

Tingkat reaksi total adalah jumlah total dari tingkat reaksi semua pereaksi, tingkat reaksi nol (0) berarti laju reaktion tersebut tidak teropengaruh oleh konsentrasi pereaksi, tetapi hanya tergantung pada harga tetapan laju (k). Harga k tergantung pada suhu, jika suhunya tetap harga k juga tetap.
Baca Juga : 60+ Soal Laju reakis Pilihan Ganda dan Jawaban [+Pembahasan]
Contoh Soal
Persamaan laju suatu reaksi tidak dapat diturunkan dari persamaan reaksi , tetapi melalui percobaan. Hasil percobaan tabel sebelumnya menunjukkan hasil percobaan penentuan laju suatu reaksi antara gas hidrogen dengan nitrogen monoksida yang dilakukan pada suhu 800o C, dengan persamaan reaksi :
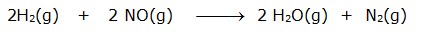
Hasil Percobaan Penentuan Persamaan antara gas NO dan gas H2 pada 800oC.
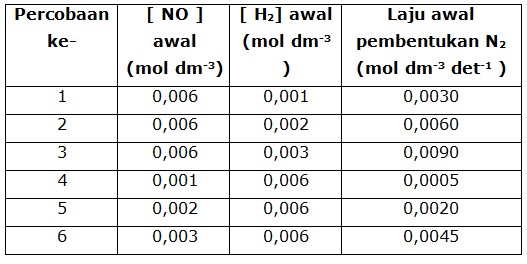
Percobaan 1 , 2 dan 3, menunjukkan konsentrasi NO dibuat tetap (sebagai variabel kontrol) untuk mengetahui pengaruh konsentrasi gas H2 terhadap laju reaksi (sebagai variabel manipulasi), dan sebaliknya percobaan 4, 5, dan 6 yang menjadi variabel kontrolnya adalah konsentrasi gas H2 dan sebagai variabel manipulasinya konsentrasi gas NO.
Dengan membandingkan percobaan 4 dan 5, terlihat bahwa jika konsentrasi NO didua-kalikan menjadi 4 kali lebih cepat, dan dari percobaan 4 dan 6 jika konsentrasi NO ditiga-kalikan laju reaksinya menjadi 9 kali lebih cepat, maka
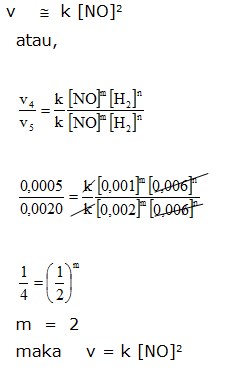
Dari percobaan 1 dan 2 didapat bila konsentrasi gas H2 didua-kalikan laju reaksinya menjadi dua kali lebih cepat, dan jika konsentrasi gas H2 ditiga-kalikan menjadi tiga kali dari laju semula, maka
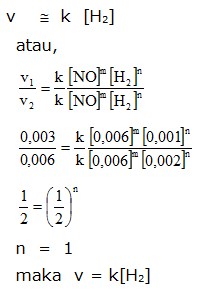
Dengan demikian persamaan laju reaksinya,
v = k [NO]2 [H2]
Harga k pada percobaan tersebut dapat dicari dengan menggunakan persamaan diatas, misalnya diambil data dari percobaan 2,

Satuan harga k dapat berubah tergantung pada tingkat (orde) reaksi totalnya. Bila dibuat kurva antara laju reaksi terhadap konsentrasi maka didapat tipe grafik seperti pada gambar. Dari kurva tersebut terlihat bahwa pada reaksi berorde nol, maka konsentrasi pereaksi tersebut tidak berpengaruh terhadap lajunya reaksi.
3. Faktor – Faktor Yang Mempengaruhi Laju Reaksi
Ada 5 Faktor utama yang mempengaruhi cepat atau lambatnya suatu reaksi dapat berjalan.
A. Teori Tumbukan
Suatu zat dapat bereaksi dengan zat lain apabila partikel-partikelnya saling bertumbukan.
- Tumbukan yang terjadi tersebut akan menghasilkan energi untuk memulai terjadinya reaksi.
- Terjadinya tumbukan antar partikel disebabkan oleh karena partikel-partikel (molekul-molekul) zat selalu bergerak dengan arah yang tidak teratur.
- Tumbukan antara partikel-partikel yang bereaksi tidak selalu menghasilkan energi, hanya tumbukan yang menghasilkan energi yang cukup yang dapat menghasilkan reaksi.
Model tumbukan antar partikel dapat digambarkan sebagai bola yang akan menggelinding dari lekukan suatu bukit ke lereng bukit, diperlukan energi supaya bola menggelinding mencapai puncak lekukan (keadaan transisi), setelah mencapai keadaan transisipun masih diperlukan energi agar bisa terlepas dari puncak lekukan tersebut agar bisa menggelinding ke lereng gunung jika energi tidak cukup maka bola tersebut akan menggelinding kembali ke lekukan itu.

Energi yang diperlukan agar bola sampai ke puncak bukit dan menggelinding dianalogikan sebagai energi pengaktifan.
Dalam reaksi kimia Energi Pengaktifan (Energi Aktivasi) merupakan energi minimum agar suatu reaksi dapat berlangsung.
Tumbukan yang menghasilkan energi yang cukup untuk menghasilkan reaksi disebut dengan tumbukan efektif. Dengan menggunakan teori tumbukan ini dapat dijelaskan bagaimana faktor – faktor yang dapat mempercepat laju reaksi.
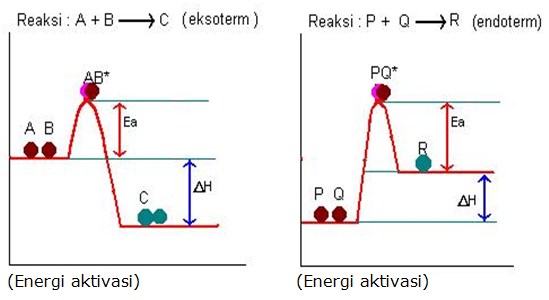
Diagram Energi pada reaksi eksoterm dan endoterm
B. Konsentrasi
Secara umum konsentrasi pereaksi akan mempengaruhi laju, pengaruh konsentrasi terhadap laju suatu reaksi untuk adalah khas untuk setiap reaksi. Pada reaksi orde-0 (nol) perubahan konsentrasi pereaksi tidak berpengaruh terhadap laju reaksinya.
Reaksi orde-1 (satu) setiap kenaikan konsentrasi dua kali akan mempercepat laju reaksi menjadi dua kali lebih cepat, sedangkan untuk reaksi orde-2 bila konsentrasi dinaikan menjadi dua kali menjadi empat kali lebih cepat. Pengaruh konsentrasi terhadap laju reaksi ini dapat dijelaskan dengan model teori tumbukan.
Makin tinggi konsentrasi berarti makin banyak molekul-molekul dalam setiap satuan luas ruangan, dengan demikian tumbukan antar molekul makin sering terjadi, semakin banyak tumbukan yang terjadi berarti kemungkinan untuk menghasilkan tumbukan efektif semakin besar, dan reaksi berlangsung lebih cepat.
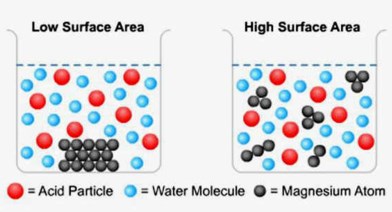
C. Luas Permukaan Sentuhan
Untuk reaksi heterogen (fasenya tidak sama), misalnya logam seng dengan larutan asam klorida, laju suatu reaksi selain dipengarhui oleh konsentrasi asam klorida juga dipengaruhi oleh kondisi logam seng. Dalam jumlah (massa) yang sama butiran logam seng akan bereaksi lebih lambat habis daripada serbuk seng.
Reaksi terjadi antara molekul – molekul asam klorida dalam larutan dengan atom-atom seng yang bersentuhan langsung dengan asam klorida. Pada butiran seng atom – atom seng yang bersentuhan langsung dengan asam klorida lebih sedikit daripada pada serbuk seng, sebab atom-atom seng yang bersetuhan hanya atom seng yang ada dipermukaan butiran, tetapi bila butiran seng tersebut dipecah menjadi butiran – butiran yang lebih kecil, atau menjadi serbuk, maka atom-atom seng yang semula didalam akan berada dipermukaan dan terdapat lebih banyak atom seng yang secara bersamaan bereaksi dengan larutan asam klorida.
Dengan menggunakan teori tumbukan dapat dijelaskan bahwa semakin luas permukaan zat padat semakin banyak tempat terjadinya tumbukan antar partikel zat yang bereaksi.
D. Pengaruh Suhu terhadap Laju Reaksi
Harga tetapan laju reaction (k) akan berubah bila suhunya berubah, kenaikan sekitar 10oC akan menyebabkan harga tetapan laju menjadi dua atau tiga kali. Dengan naiknya harga tetapan laju (k), maka reaksi akan menjadi lebih cepat.
Jadi dengan naiknya suhu akan mengakibatkan laju reaksi akan berlangsung makin cepat.
Hal tersebut dapat dijelaskan dengan menggunakan teori tumbukan, yaitu bila terjadi kenaikan suhu maka molekul – molekul yang bereaksi akan bergerak lebih cepat, sehingga energi kinetiknya tinggi.
Karena energi kinetiknya tinggi maka energi yang dihasilkan pada tumbukan antar molekul akan menghasilkan energi yang besar dan cukup untuk berlangsungnya reaksi. Dengan demikian semakin tinggi suhu berarti akan kemungkinan terjadinya tumbukan yang menghasilkan energi juga semakin banyak, dan berakibat reaksi berlangsung lebih cepat.
Contoh Soal
Bila pada setiap kenaikan ΔtoC suatu reaksi berlangsung n kali lebih cepat maka laju suatu reaksi pada t2 (V2) bila dibandingkan laju suatu reaksi pada t1 (V1) dapat dirumuskan :

E. Katalisator
Beberapa reaksi kimia yang berlangsung lambat dapat dipercepat dengan menambahkan suatu zat ke dalamnya, tetapi zat tersebut pada waktu reaksi selesai ternyata tidak berubah, misalnya pada peruraian kalium klorat untuk menghasilkan gas oksigen dengan persamaan reaksi :
2KClO3(s) → 2 KCl(s) + 3 O2(g)
berlangsung pada suhu tinggi dan berjalan lambat, tetapi dengan penambahan kristal MnO2 ke dalamnya ternyata reaksi akan dapat berlangsung dengan lebih cepat pada suhu yang lebih rendah. Setelah semua KClO3 terurai ternyata MnO2 masih tetap ada (tidak berubah). Dalam reaksi tersebut MnO2 disebut sebagai katalisator.
Katalisator adalah suatu zat yang dapat mempercepat laju reaksi, tanpa dirinya mengalami perubahan yang kekal. Suatu katalisator mungkin dapat terlibat dalam proses reaksi atau mengalami perubahan selama reaksi berlangsung, tetapi setelah reaksi itu selesai maka katalistor akan diperoleh kembali dalam jumlah yang sama.
Katalisator mempercepat reaksi dengan cara mengubah jalannya reaksi, dimana jalur reaksi yang ditempu tersebut mempunyai energi aktivasi yang lebih rendah daripada jalur reaksi yang biasanya ditempuh, jadi dapat dikatakan bahwa
katalisator berperan di dalam menurunkan energi aktivasi.
Diduga ada dua cara yang dilakukan katalisator dalam mempercepat reaksi yaitu dengan membentuk senyawa antara dan yang kedua dengan cara adsorbsi.
– Pembentukan Senyawa Antara
Umumnya reaksi berjalan lambat bila energi pengaktifan suatu reaksi terlalu tinggi, agar reaksi dapat berlangsung lebih cepat maka dapat dilakukan dengan cara menurunkan energi pengaktifan. Untuk menurunkan energi pengaktifan dapat dilakukan dengan mencari senyawa antara (keadaan tranmsisi) lain yang energinya lebih rendah.
Fungsi katalis disini mengubah jalannya reaksi sehingga didapat senyawa antara ( keadaan transisi) yang energinya realtif lebih rendah tersebut. Katalisator homogen (katalisator yang mempunyai fase yang sama dengan zat pereaksi yang dikatalis) bekerja dengan cara ini.
– Adsorbsi
Proses katalisasi dengan cara adsorbsi umumnya dilakukan oleh katalisator heterogen, yaitu katalisator yang fasenya tidak sama dengan fase zat yang dikatalisis). Pada proses adsobsi, molekul-molekul pereaksi akan teradsorbsi pada permukaan katalisator, dengan terserapnya pereaksi di permukaan katalistor mengakibatkan zat-zat pereaksi terkonsentrasi di permukaan katalisator dan ini akan mempercepat reaksi.
Kemungkinan yang lain adalah , karena pereaksi-pereaksi teradsorbsi di permukaan katalisator akan dapat menimbulkan gaya tarik antar molekul yang bereaksi, dan ini menyebabkan molekul-molekul tersebut menjadi reaktif.
Agar katalisator tersebut berlangsung efektif, katalistor tidak mengadsorbsi zat hasil reaksi, dan dengan demikian permukaan logam akan segera ditempati oleh molekul baru. Bila zat pereaksi atau pengotor teradsorbsi dengan kuat oleh katalisator menyebabkan permukaan katalis menjadi tidak aktif, dalam keadaan ini katalisator dikatakan telah teracuni, dan ini akan menghambat reaksi.
Contoh katalis adsorbsi
Nikel pada pembuatan margarin, untuk mengkatalisis reaksi antara gas hidrogen dengan lemak atau minyak menjadi margarin. Pada industri asam sulfat digunakan katalisator V2O5 untuk mempercepat reaksi antara gas SO2 dan O2 menjadi SO3.
Baca Juga : 60+ Soal Laju Reaksi Pilihan Ganda dan Jawaban [+Pembahasan]
Jenis katalis
- Katalis Homogen
Wujud katalis sama dengan wujud dari pereaksi. Jenis katalis ini umumnya ikut bereaksi, tetapi pada akhir reaksi akan kembali lagi ke bentuk semula.
- Katalis Heterogen
Wujud katalis berbeda dari wujud pereaksi. Jenis katalis ini tidak ikut bereaksi, tetapi melalui proses aksi permulaan yaitu permukaan logam menyerap molekul-molekul udara sehingga apabila dua molekul gas yang dapat bereaksi terserap akan gas-gas itu maka mudah bereaksi.
- Katalis Biokimia
Katalis yang mempercepat reksi-reaksi yang terjadi pada makhluk hidup. Katalis ini berupa enzim-enzim
Beberapa contoh enzim dan kegunaannya :
| No | Enzim | Kegunaan | Aplikasi dalam industri |
| 1 | Amilase | Menghidrolisis kanji (amilum) menjadi maltosa | Pembentukan kertas(menurunkan kekentalan produk dengan cara menguraikan kanji) |
| 2 | Katalase | Menguraikan hidrogen peroksida menjadi oksigen dan air | Industri karet (mengubah lateks menjadi karet busa) |
| 3 | Lipase | Menggunakan lipid menjadi gliserol dan asam lemak Menguraikan | Industri keju |
| 4 | Profease | protein menjadi pepsida dan asam amino | Industri roti |
- Autokatalis
Autokatalis adalah zat hasil reaksi yang berfungsi sebagai katalis. Artinya zat hasil reaksi yang terbentuk akan mempercepat reaksi kimia. Contohnya adalah reaksi antara kalium permanganat dengan asam oksalat dan perusakan lapisan ozon.
Kesimpulan
Dari keterangan diatas dapat disimpulkan, laju suatu reaksi adalah perubahan konsentrasi pereaksi atau hasil reaksi dalam satuan waktu. dan terdapat faktor-faktor yang mempengaruhi, yaitu : Konsentrasi, luas permukaan sentuhan, suhu dan katalis.
Katalis adalah suatu zat yang dapat mempercepat atau memperlambat katalis yang mempercepat laju suatu reaksi disebut katalisator dan katalis yang memperlambat disebut inhibitor. Jenis katalis ada empat, yaitu : Katalis Homegen, Katalis Heterogen, Katalis Biokimia, dan Autokatalis. Orde suatu reaksi adalah jumlah pangkat faktor konsentrasi dalam hukum laju bentuk diferensial.
Sudah selesai membaca materi ini ? Ayo lihat dulu Daftar Materi Kimia



