Contoh Soal Kimia Kelas 11 Semester 1 dan Jawaban beserta pembahasan – Pelajaran kimia kelas 11 yang paling sering dipelajari siswa adalah berhitung dan berlogika sehingga siswa tidak boleh tertinggal dalam belajar karena akan sulit mengikuti materi berikutnya.

Mata pelajaran kimia kelas 11 semester sebagai berikut :
Kali Ini Soalkimia.com akan membagikan Soal Kimia Kelas 11 Semester 1 Kurikulum 2013 (K.13) dan Jawabannya berupa Pilihan Ganda untuk kamu pelajari.
1 – 20 Soal Kimia Kelas 11 SMA Semester 1 Kurikulum 2013
1. Menurut teori asam-basa Bronsted-Lowry, asam didefinisikan sebagai zat yang . . . .
a. Meningkatkan [H+] bila dimasukkan kedalam H2O
b. Menurunkan [H+] bila dimaasukkan kedalam H2O
c. Meningkatkan [OH–] bila dimasukkan kedalam H2O
d. Menerima 1 H+ dari pasangan reaksinya
e. Memberi 1 H+ dari pasangan reaksinya
Pembahasan:
Teori asam Brosnted-Lowry:
Asam: zat yang memberikan 1 H+ pada pasangan reaksinya.
Basa: zat yang menerima 1 H+ dari pasangan reaksinya.
Jawaban: D
2. Kertas lakmus biru akan berubah menjadi merah, bila dimasukkan ke dalam larutan…
a. Kalium hidroksida
b. Natrium klorida
c. Barium sulfat
d. Asam klorida
e. Natrium nitrat
Pembahasan:
Kertas lakmus adalah kertas yang diberi suatu senyawa kimia sehingga akan menunjukkan warna yang berbeda setelah dimasukkan pada larutan asam maupun basa.
Warna kertas lakmus akan berubah sesuai dengan larutannya. Kertas lakmus biru akan berubah menjadi merah bila dimasukkan kedalam larutan asam klorida, karena asam klorida merupakan asam kuat.
Jawaban : D
3. Untuk mengukur derajat keasaman asam atau basa yang akurat, paling tepat menggunakan. . . .
a. Fenolftalein
b. Metil jingga
c. pH meter
d. Bromtimol biru
e. Universal
Pembahasan:
pH meter adalah alat pengukur pH dengan ketelitian yang sangat tinggi. pH meter dapat menyatakan pH larutan sampai dua angka desimal pada suhu tertentu.
Jawaban: C
4. Reaksi yang tidak menghasilkan gas adalah . . . .
a. Logam magnesium dengan asam klorida encer
b. Natrium karbonat padat dengan asam sulfat encer
c. Logam besi dengan asam sulfat encer
d. Amonium klorida dengan natrium hidroksida
e. Logam tembaga dengan asam klorida encer
Pembahasan:
Cu tidak bereaksi dengan HCl karena Cu terletak disebelah kanan H dalam deret volta. Logam-logam yang terletak disebelah kanan H dalam deret volta bersifat mulia atau setengah mulia.
Logam setengah mulia seperti Cu hanya larut dalam asam oksidator( asam sulfat pekat, asam nitrat pekat dan asam nitrat encer ) sedangkan logam mulia seperti emas dan platina hanya larut dalam campuran HCl pekat dan asam nitrat pekat.
Jawaban: E
Baca Juga : 50 Soal Kimia Kelas 10 Semester 1 dan Jawabannya Kurikulum 2013
6. Derajat keasaman dari larutan 100 ml H2SO4 0,02 M adalah . . . .
a. 2 – log 4
b. 2 + log 4
c. 2 + log 2
d. 12 + log 4
e. 12
Pembahasan:
H2SO4 merupakan asam kuat, bervalensi 2
[H+] = Ma x Val
= 0,02 x 2 = 4 x 10-2
pH = -log 4 X 10-2
= 2-log 4
Jawaban: A
7. Berapakah konsentrasi ion [OH–] dalam larutan jika konsentrasi H+ = 2 X 10-4 M (Diketahui Kw= 10-14)…….
a. 5 X 10-10
b. 5 X 10-18
c. 0,2 X 10-10
d. 0,2 X 10-8
e. 2 X 10-10
Jawaban: A
Pembahasan:
Dalam larutan dengan pelarut air, berlaku :
[H+] [OH–] = 10-14, jika [H+] = 2 x 10-4 M,
maka :
8. Larutan yang mempunyai pH lebih besar dari 7 adalah . . . .
a. Gula
b. Alkohol
c. Amoniak
d. Asam nitrat
e. Asam klorida
Pembahasan:
pH gula adalah netral(pH=7), sedangkan asam memiliki pH<7, pH alkohol adalah hampir netral 7,33.
Amoniak merupakan basa, yang memiliki pH=12. Sehingga larutan yang mempunya pH lebih besar dari 7 adalah amoniak
Jawaban: C
8. Larutan asam lemah NH4OH 0,1 M,dan Kb = 10-5,nilai pH larutan tersebut adalah… . .
a. 11
b. 3
c. 9
d. 14
e. 6
Jawaban : A
Pembahasan :
9. dari senyawa-senyawa dibawah berikut yang berperan sebagai asam Bronsted dan basa Bronsted adalah…..
a. Cl–
b. H2O
c. CO2
d. CO32-
e. NO3–
Jawaban: B
Pembahasan:
H2O dapat berperan sebagai asam Bronsted karena mengandung atom hydrogen dengan bilangan oksidasi +1.
Dan dapat juga berperan sebagai basa Bronsted karena mengandung paling sedikit satu pasang elektron bebas. Hal ini dapat ditinjau dari struktur Lewis H2O
10. Diantara zat-zat berikut yang memiliki keasaman paling kuat adalah….
a. HCN (Ka = 6,0 x 10-10)
b. CH3COOH (Ka = 1,8 x 10-5)
c. HCl (Ka = 1 x 106 )
d. NH3 (Ka = 10-33)
e. H2O (Ka = 1,8 x 10-16)
Pembahasan:
Berdasarkan nilai Ka urutan keasaman adalah sebagai berikut:
NH3< H2O <HCN <CH3COOH <HCl
Jadi, HCl adalah zat yang memiliki keasaman paling kuat
Jawaban: C
Baca Juga : Soal Laju Reaksi
11. Diantara spesi berikut manakah yang tidak berlaku sebagai asam Bronsted-Lowry…..
a. NH4+
b. H2O
c. HCO3–
d. CO32-
e. H2CO3
Pembahasan:
Berdasarkan teori Bronsted-Lowry, asam didefinisikan sebagai pendonor 1 ion H+ pada basa, dan basa didefinisikan sebagai penerima 1 ion H+ dari asam.
Spesi yang tidak memiliki atom H tidak dapat berperan sebagai pendonor H+, oleh karena itu spesi yang tidak berlaku sebagai asam Bronsted-Lowry ialah CO32-
Jawaban: D
12. Larutan CH3COOH 0,01 M,Harga Ka = 1,8 x 10-5,nilai kosentrasi ion H+ larutan tersebut adalah……
a. 8 x 10-7
b. 4,2 x 10-4
c. 4,2 x 10-6
d. 2,4 x 10-4
e. 2,4 x 10-6
Pembahasan:
13. Berapa harga Ka asam asetat jika 0,1 mol CH3COOH dalam 1 liter laerutan mengandung 0,001 M ion H+?
a. 1 x 10-7
b. 1 x 10-6
c. 1 x 105
d. 1 x 10-5
e. 1 x 106
Pembahasan :
Jawaban : D
14. Hitunglah pH larutan jika 17,1 gram Ba(OH)2 dilarutkan dalam air sehingga volume larutan menjadi 500 mL.(Ar Ba = 137; O = 16; H = 1)
a. 13,60
b. 16,30
c. 8
d. 9,70
e. 11
Jawaban: A
Pembahasan :
15. Perhatikan data pengujian pH beberapa sampel air limbah berikut!
Jenis air limbah | P | Q | R | S | T |
pH | 8 | 5,5 | 7,6 | 9,4 | 4,7 |
Air limbah yang tercemar asam adalah . . . .
a. P dan Q
b. Q dan T
c. R dan S
d. S dan T
e. T dan R
Pembahasan:
Nilai pH untuk asam <7 sehingga berdasarkan data diatas dapat diketahui air limbah yang tercemar asam adalah Q dan T
Jawaban: B
Baca Juga : Soal Termokimia
16. Beberapa larutan diuji dengan kertas lakmus didapat hasil sebagai berikut.
Larutan | Lakmus Merah | Lakmus biru |
1 | Merah | Merah |
2 | Biru | Biru |
3 | Merah | Merah |
4 | Biru | Biru |
5 | Merah | Biru |
Berdasarkan data di atas, larutan yang bersifat asam adalah…..
a. Larutan 1 dan 2
b. Larutan 1 dan 3
c. Larutan 2 dan 3
d. Larutan 2 dan 4
e. Larutan 4 dan 5
Jawaban : B
Pembahasan :
Lakmus merupakan salah satu indikator pH dengan perubahan warna merah ke biru trayek pH 4,5-8,3.
Lakmus merah dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru. Lakmus biru dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru.
17. Menurut konsep asam-basa Bronsted-Lowry dalam reaksi
NH3 + H2O → NH4+ + OH–
Dapat ditarik kesimpulan…..
a. Air adalah asam karena dapat menerima sebuah proton
b. Amonia dan air adalah pasangan asam-basa konjugat
c. NH3 dan NH4+ adalah pasangan asam-basa konjugat
d. NH3 adalah asam karena memberi sebuah proton
e. NH4+ dan OH– adalah basa kuat
Jawaban : C
Pembahasan :
Menurut Bronsted-Lowry:
Asam adalah suatu spesies kimia (molekul atau ion) yang dapat mendonorkan suatu proton kepada spesies kimia yang lain atau dengan kata lain sebagai proton donor.
Basa adalah suatu spesies kimia (molekul atau ion) yang dapat menerima suatu proton dari spesies kimia yang lain atau dengan kata lain sebagai proton akseptor.
- Pernyataan A tidak tepat karena asam menurut Bronsted-Lowry adalah bertindak sebagai donor proton.
- Pernyataan B tidak tepat karena pasangan asam basa yaitu NH3 – NH4+ dan H2O – OH–.
- Pernyataan D tidak tepat karena yang bertindak sebagai asam adalah H2O.
- Pernyataan E tidak tepat karena tidak sesuai dengan konsep asam-basa Menurut Bronsted-Lowry.
Pernyataan yang tepat adalah yang C karena molekul H2O bertindak sebagai asam yang mendonorkan proton ke molekul NH3 sebagai basa. Demikian pula ion NH4+ bertindak sebagai asam yang mendonorkan protonnya ke ion OH– sebagai basa.
18. Larutan dengan pH=12 dibuat dengan melarutkan a gram NaOH (Mr=40) ke dalam air hingga volum larutan 500ml. besarnya a adalah…..
a. 4,0
b. 2,0
c. 1,0
d. 0,4
e. 0,2
Pembahasan :
Jawaban : E
19. Asam HA 0,1 M jika ditetesi indikator universal akan memberikan warna yang sama jika HCl 0,001 M ditetesi dengan indikator yang sama, maka harga Ka asam HA tersebut adalah…..
a. 1 x 10-5
b. 1 x 10-6
c. 2 x 10-6
d. 4 x 10-7
e. 2 x 10-8
Jawaban : A
Pembahasan :
20. Asam sulfat sebanyak 20 ml dititrasi dengan larutan NaOH 0,1 M. Jika ternyata diperlukan 30 ml NaOH, kemolaran larutan asam sulfat tersebut adalah…..
a. 0,075 M
b. 0,10 M
c. 0,15 M
d. 0,20 M
e. 0,30 M
Jawaban : C
V1M1 = V2M2
M1 = V2M2 / V1
M1 = 0,15 M
21 – 40 Soal Kimia Kelas 11 SMA Semester 1 K.13
21. Asam HA mempunyai pKa = 3,2. Sebanyak x mol NaA ditambahkan ke dalam 500 mL larutan 0,2 M HA dan ternyata pH larutan adalah 3,5. Maka x adalah…
a. 0,025
b. 0,05
c. 0,10
d. 0,20
e. 0,25
Jawaban : D
Pembahasan :
Mol HA = 0,5 L x 0,2 M = 0,1 mol
pH = 3,5 jadi [H+] = 10-3,5
pKa = 3,2 jadi Ka = 10-3,2
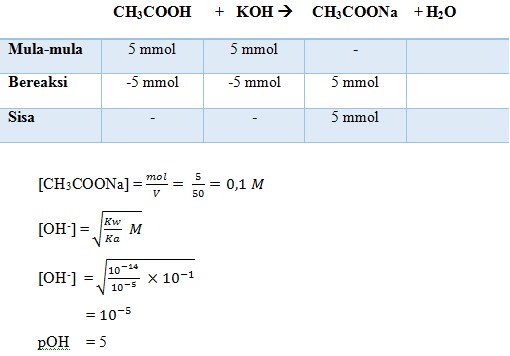
22. Untuk membuat larutan penyangga yang mempunyai pH = 4, ke dalam 100 ml larutan CH3COOH 0,5 M (Ka = 10-5) harus ditambah larutan CH3COONa 0,05 M sebanyak…
a. 100 ml
b. 50 ml
c. 10 ml
d. 5 ml
e. 1 ml
Jawaban : A
Pembahasan :
23. Jika 50 ml larutan CH3COOH 0,1 M dicampurkan dengan 100 ml CH3COONa 0,2 M (Ka CH3COOH = 1,8 x 10-5), maka pH campuran adalah…
a. 5,35
b. 5,05
c. 4,5
d. 5
e. 3,5
Jawaban : A
Pembahasan :
Jumlah mmol CH3COOH = 50 ml x 0,1 M = 5 mmol
Jumlah mmol CH3COONa = 100 ml x 0,2 M = 20 mmol
pH = -log [H+]
= 6 – log 4,5
= 6 – 0,65
= 5,35
Jadi, pH campuran tersebut 5,35
24. Larutan penyangga dibuat dengan mencampurkan larutan NH3 dengan NH4Cl dengan perbandingan mol 1 : 9. Jika Kb = 1,8 x 10-5, pH campuran tersebut adalah…
a. 6 – log 2
b. 6 + log 2
c. 8 – log 2
d. 8 + log 2
e. 9 + log 2
Jawaban : D
Pembahasan :
NH3 + NH4Cl = 1 : 9
pOH = 6 – log 2
pH = 14 – (6 – log 2)
= 8 + log 2
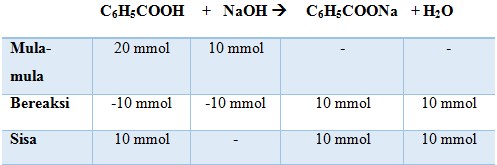
25. Harga pH campuran antara 100 ml larutan C6H5COOH 0,2 M dengan 100 ml larutan NaOH 0,1 M jika diketahui Ka C6H5COOH = 6 x 10-5..
a. 4 + log 6
b. 5 – log 6
c. 5 + log 5
d. 6 – log 5
e. 6 + log 6
Jawaban : B
Pembahasan :
Mol C6H5COOH = 100 ml x 0,2 M = 20 mmol
Mol NaOH = 100 ml x 0,1 M = 10 mmol
Baca Juga : Soal Struktur Atom
26. Larutan penyangga dengan pH 8,5 dibuat dengan mengalirkan gas NH3 ke dalam 250 ml NH4Cl 0,05 M. Jika Kb NH3 = 10-5, volume NH3 yang dialirkan (diukur pada STP) sebanyak…ml.
a. 28,5
b. 42,0
c. 56,5
d. 70,0
e. 88,5
Jawaban : E
Pembahasan :
Mol NH4Cl = 250 ml x 0,05 = 12,5 mmol
pH = 8,5
pOH = 14 – 8,5 = 5,5
[OH–] = 10-5,5
27. Sebanyak 0,28 gram kristal KOH ditambahkan ke dalam 50 ml larutan CH3COOH 0,1 M (Ka = 10-5). pH larutan yang terjadi jika diketahui Ar K = 39, O = 16, dan H =1 adalah…
a. 3
b. 6
c. 7
d. 9
e. 12
Jawaban : D
Pembahasan :
CH3COOH = 0,1 x 50 = 5 mmol
KOH = 0.28/56 = 0,005 mol = 5 mmol
pH = 14 – 5 = 9
28. Massa CH3COONa (Mr = 82) yang harus ditambahkan ke dalam 1.000 ml larutan CH3COOH 0,1 M agar pH-nya 6 adalah…gram.
(Ka CH3COOH = 1 x 10-5)
a. 8,2
b. 16,4
c. 24,6
d. 82
e. 164
Jawaban : D
Pembahasan :
Mol CH3COOH = 1 L x 0,1 M = 0,1 mol
pH = 6 → [H+] = 10-6
29. Jika suatu asam lemah dengan Ka = 10-5 dilarutkan bersama-sama dengan garam natriumnya dalam perbandingan mol asam dan garamnya 1 : 10, pH larutan yang dihasilkan adalah…
a. 2
b. 3
c. 4
d. 5
e. 6
Jawaban : E
Pembahasan :
30. Sebanyak 0,082 gram suatu garam ditambahkan ke dalam 10 ml larutan asam asetat 0,1 M (Ka = 10-5). pH yang terbentuk adalah 5. Massa molekul relatif garam tersebut adalah…gram/mol.
a. 66
b. 82
c. 83
d. 98
e. 99
Jawaban : B
Pembahasan :
Mol CH3COOH = 10 ml x 0,1 M = 1 mmol
pH = 5 → [H+] = 10-5
Baca Juga : Buku Kimia Kelas XI
31. Pada kondisi normal, pH dari darah manusia dan jaringan harus dijaga antara ….
a. 3 – 4
b. 7,35 – 7,45
c. 5,56 – 5,68
d. 8,55 – 8,65
e. 1 – 2
Jawaban: B
Pembahasan:
Darah mempunyai pH yang relatif tetap disekitar 7,4. Hal ini dimungkinkan Karena adanya sistem penyangga / , sehingga meskipun setiap saat darah kemasukan berbagai zat yang bersifat asam maupun basa, tetapi pengaruhnya terhadap perubahan pH dapat dinetralisir.
Jika darah kemasukan zat yang bersifat asam, maka ion dari asam tersebut akan bereaksi dengan ion . Sebaliknya, jika darah kemasukan zat yang bersifat basa, maka ion akan bereaksi dengan .
Darah mempunyai kisaran pH 7,0 – 7,8. Diluar nilai tersebut akan berakibat fatal terhadap tubuh. Penyakit dimana pH darah terlalu tinggi disebut alkalosis, dan bila pH darah terlalu rendah disebut asidosis.
Sehingga dari soal tersebut lebih tepat jawabannya pada pH yang relatif tetap disekitar 7,4.
32. Diantara campuran berikut, yang dapat membentuk larutan penyangga adalah….
a. HCl dan NH4Cl
b. NaOH dan CH3COONa
c. HBr dan NaBr
d. KOH dan KCl
e. NH4OH dan NH4Cl
Jawaban: B
Pembahasan:
Campuran yang dapat membentuk larutan penyangga yaitu:
- Basa kuat dan asam lemah
- Asam kuat dan basa lemah
Berdasarkan soal tersebut yang termasuk dalam campuran yang membentuk larutan penyangga pada basa kuat dan asam lemah yaitu NaOH dan CH3COONa
33. Diantara pernyataan berikut yang merupakan fungsi larutan penyangga dalam tubuh manusia, yaitu ….
a. menjaga kesetimbangan cairan yang ada di luar dan di dalam sel
b. menjaga pecahnya pembuluh darah
c. menjaga pH darah agar tidak banyak berubah
d. menjaga masuknya cairan ke dalam sel
e. menjaga masuknya pelarut melalui selaput semipermeable
Jawaban: A
Pembahasan:
Dalam tubuh manusia terdapat sistem penyangga yang berfungsi untuk mempertahankan pH, diperlukan lingkungan reaksi dengan pH yang reatif tetap, maka diperlukannnya larutan penyangga.
Di dalam setiap cairan tubuh terdapat pasangan asam basa konjugasi yang berfungsi sebagai larutan penyangga, cairan tubuh, baik intra sel maupun ekstra sel memerlukan sistem penyangga untuk mempertahankan nilai pH kesetimbangan cairan.
Sistem penyangga ekstra sel yaitu penyangga karbonat / dalam menjaga pH darah. Sedangkan sistem penyangga intrasel yaitu system penyangga fosfat H2PO4- / HPO4²‾
34. Tersedia beberapa campuran sebagai berikut:
- 1) HNO3 dan NaNO3
- 2) CH3COOH dan CH3COONa
- 3) CH3COONa dan NaOH
- 4) NH3 dan NH4Cl
Larutan buffer dihasilkan oleh campuran nomor ….
a. 1 dan 2
b. 1 dan 3
c. 1 dan 4
d. 2 dan 3
e. 2 dan 4
Jawaban: E
Pembahasan:
Larutan buffer dapat dibentuk melalui bebrapa cara, yaitu campuran:
- Asam lemah + garamnya
CH3COOH dan CH3COONa
- Basa lemah + garamnya
NH3 dan NH4Cl
35. Data percobaan ph beberapa larutan sebagai berikut.
larutan | pH awal | Ph dengan penambahan sedikit | |
asam | basa | ||
I | 5,60 | 6,00 | 5,00 |
II | 5,40 | 5,42 | 5,38 |
III | 5,20 | 5,25 | 5,18 |
IV | 8,20 | 8,80 | 7,80 |
V | 9,20 | 9,60 | 8,70 |
Larutan yang mempunyai sifat penyangga adalah…
a. I dan II
b. II dan III
c. III dan IV
d. III dan V
e. IV dan V
Jawaban: B
Pembahasan:
Larutan dikatakan bersifat penyangga jika pada larutan ditambahkan sedikit asam basa atau air ph nya cenderung tidak atau sedikit mengalami perubahan.
Berdasarkan data percobaan II dan III merupakan larutan penyagga karena mengalami sedikit perubahan pH. Larutan dikatakan bukan penyangga jika pada larutan itambah sedikit asam, basa, atau air terjadi perubahan pH yang cukup besar, larutan yang bukan penyangga yaitu larutan I, IV dan V.
Baca Juga : Soal dan Tata nama Senyawa dan Persamaan Reaksi Sederhana
36. Larutan buffer dapat di buat dengan mencampurkan larutan – larutan….
a. asam sulfat dan natrium sulfat
b. natrium hidroksida dan natrium nitrat
c. ammonium hidroksida dan ammonium sianida
d. asam asetat dan ammonium asetat
e. asam sianida dan kalium sianida
Jawaban: A
Pembahasan:
Larutan penyagga dapat dibuat dengan cara yaitu mencampurkan asam lemah dengan garamnya atau mencampurkan asam lemah dan basa lemah dengan basa kuat atau basa kuat.
37. Pernyataan yang benar tentang larutan penyagga adalah…
a. mempertahankan ph system agar tetap
b. memiliki komponen asam dan basa yang selalu berupa pasangan konjugasi
c. mampu mengatasi penambahan asam dan basa dalam jumlah yang banyak
d. memiliki kapasitas tertentu
e. pengenceran tidak mengubah konsentrasi ion H+ dan OH-
Jawaban: A
Pembahasan:
Larutan penyangga adalah larutan yang mampu mempertahan kan (penyagga) ph pada pada kisarannya apabila terjadi penambahan sedikit asam, sedikit basa atau terjadi pengenceran.
38. Pernyataan tentang larutan penyangga yang paling tepat adalah….
a. pH larutan penyangga tidak mungkin berubah oleh penambahan asam dan basa.
b. larutan penyangga dapat dibuat dari campuran garam dengan basa kuat berlebih.
c. larutan penyangga dapat dibuat dari larutan basa dengan asam kuat berlebihan
d. larutan penyangga dapat dibuat dari campuran larutan asam lemah dengan basa konjugasinya
e. larutan penyangga dapat dibuat dari cmpuran asam kuat berlebih dengan basa lemah.
Jawaban: D
Pembahasan:
Larutan penyangga merupakan larutan yang pH nya relatif tetap (tidak berubah) dan juga mempertahankan nilai pH nya meskipun terjadi penambahan sedikit asam dan atau sedikit basa. Ditinjau dari komposisi zat penyusunan, terdapat dua sistem larutan penyangga, yaitu sistem penyangga asam lemah dengan basa dan sistem penyangga basa lemah dengan asam konjugasinya.
39. Perhatikan data percobaan berikut!
Larutan | I | II | III | IV | V |
pH awal | 3 | 5 | 7 | 9 | 11 |
Ditambah sedikit asam | 1 | 3 | 5 | 8,9 | 9 |
Ditambah sedikit basa | 5 | 6,5 | 8 | 9,2 | 12 |
Ditambah sedikit air | 4 | 6 | 7 | 9 | 10,5 |
Berdasarkan data tersebut, larutan penyangga terdapat pada nomor ….
a. I
b. II
c. III
d. IV
e. V
Jawaban : D
Pembahasan :
Ciri-ciri larutan penyangga: saat ditambah sedikit air atau sedikit basa atau sedikit asam nilai pH relatif tetap, jika terjadi perubahan hanya relatif kecil. Dan larutan yang paling mendekati perubahan pH setelah penambahan air, asam dan basa adalah larutan 4.
40. Gelas kimia I berisi larutan HCOOH 0,2 M dan gelas kimia II berisi larutan (HCOO)2Ba 0,3 M. Perbandingan volume gelas kimia I dan gelas kimia II untuk meghasilkan pH larutan penyangga = 5 adalah…
(Ka HCOOH = 2 x 10-4)
a. 3 : 20
b. 3 : 3
c. 4 : 3
d. 20 : 5
e. 5 : 20
Jawaban : A
Pembahasan :
pH = 5 sehingga [H+] = 10-5
jumlah mmol HCOOH = V1 x 0,2 M = 0,2 V1 mmol
jumlah mmol (HCOO)2Ba = V2 x 0,3 M = 0,3 V2 mmol
Jumlah anion atau basa konjugasi, yaitu HCOO– yang diikat adalah 2 sehingga
Jadi, perbandingan volume gelas kimia I : gelas kimia II adalah 3 : 20
41 – 60 Soal Kelas 11 SMA Semester 1
41. Jika suatu asam kuat dicampur dengan basa lemah, maka akan terbentuk larutan garam yang bersifat . . . .
a. Asam jika Ka > Kb
b. Basa jika Ka<Kb
c. Netral
d. Asam
Pembahasan
Sifat larutan garam yang terhidrolisis dapat dikelompokan berdasarkan jenis asam dan basa pembentuknya :
- Garam dari asam kuat dan basa lemah terhidrolisis mebentuk larutan garam yang bersifat asam (pH < 7)
- Garam dari asam lemah dan basa kuat terhidrolisis mebentuk larutan garam yang bersifat basa (pH > 7)
- Garam dari asam lemah dan basa lemah terhidrolisis membentuk larutan garam yang dapat bersifat asam, basa, atau netral.
- Larutan garam bersifat asam (pH < 7 ) jika Ka>Kb
- Larutan garam bersifat basa (pH > 7 ) jika Ka<Kb
- Larutan garam bersifat netral (pH = 7) jika Ka = Kb
Jawaban : D
42. Larutan garam yang berasal dari asam lemah dan basa lemah akan bersifat asam, jika . . . .
a. Ka>Kb
b. Ka<Kb
c. Kb>Ka
d. Ka = Kb
Jawaban : A
Pembahasan
Garam dari asam lemah dan basa lemah terhidrolisis membentuk larutan garam yang dapat bersifat asam, basa, atau netral.
- Larutan garam bersifat asam (pH < 7 ) jika Ka>Kb
- Larutan garam bersifat basa (pH > 7 ) jika Ka<Kb
- Larutan garam bersifat netral (pH = 7) jika Ka = Kb
Ka>Kb( Asam ) Ka = Kb( Netral )
Ka<Kb ( Basa ) Kb>Ka( Basa )
43. Jika Ka (CH3COOH) = 1 X 10-5 maka pH larutan CH3COONa 0,1 M adalah ….
a. 3
b. 9
c. 11
d. 7
e. 13
Jawaban : B
Pembahasan :
Untuk 1,0 L terdapat 0,1 mol CH3COONa yang akan terurai membentuk 0,1 mol anion CH3COO–.
CH3COONa → Na+ + CH3COO–
CH3COO– + H2O ↔ CH3COOH + OH–
44. Larutan KCN dalam air akan bersifat basa, reaksi yang menunjukkan terjadinya sifat basa tersebut adalah…
a. K+ + OH–→ KOH
b. CN– + H+ → HCN
c. K+ + H2O → KOH + H+
d. CN– + KOH → KCN + OH–
e. CN– + H2O → HCN + OH–
Jawaban : E
Pembahasan :
Karena Hidrolisis yang berasal dari asam lemah menghasilkan ion OH– . akibatnya kosentrasi ion OH– menjadi lebih tinggi dibandingkan konsentrasi ion H+. Dengan demikian, larutan garam tersebut bersifat basa dan memiliki pH > 7.
45. Diantara garam-garam berikut yang mengalami hidrolisis total dalam air adalah…
a. NH4Cl
b. NH4CN
c. KCN
d. CuSO4
e. MgSO4
Jawaban : B
Pembahasan :
Hidrolisis yang berasal dari asam lemah dan basa lemah merupakan hidrolisis total, sebab kedua ion garam mengalami reaksi hidrolisis dengan air.
Dari soal diatas penyusun dari garam NH4CN adalah NH4OH ( basa lemah ) dan HCN ( asam lemah ) Dan akan terjadi hidrolisis total. Maka NH4CN akan terionisasi menjadi NH4+ dan CN–
NH4CN → NH4+ + CN–
kedua ion tersebut dapat terhidrolisis dengan reaksi berikut :
NH4+ + H2O → NH4OH + H+
CN– + H2O → HCN + OH–
Oleh karena dihasilkan ion H+ dan OH– maka sifat larutan ditentukan oleh nilai tetapan kesetimbangan dari kedua reaksi tersebut.
Baca Juga : Soal dan Pembahasan Literasi Sains Kimia
46. Garam yang mengalami hidrolisis sebagian dan bersifat asam adalah..
a. CH3COONa
b. HCOOK
c. NH4Cl
d. KCl
e. CH3COONH4
Jawaban : C
Pembahasan :
Garam yang berasal dari asam kuat dan basa lemah yaitu contohnya NH4Cl jika dilarutkan dalam air akan menghasilkan kation yang berasal dari basa lemah, kation tersebut bereaksi dengan air dan menghasilkan ion H+ yang menyebabkan larutan bersifat asam.
NH4Cl → NH4+ + Cl–
Ion NH4+ bereaksi dengan air membentuk reaksi kesetimbangan :
NH4+ + H2O ↔ NH4OH + H+
Adanya ion H+ yang dihasilkan reaksi tersebut mengakibatkan konsentrasi ion H+ didalam air lebih banyak dibandingkan dengan konsentrasi ion OH– sehingga larutan bersifat asam.
Dari kedua ion yang dihasilkan oleh garam tersebut hanya ion NH4+ yang mengalami hidrolisis, sedangkan Cl– tidak bereaksi dengan air. Jika dianggap bereaksi maka HCl yang terbentuk akan segera terionisasi menghasilkan ion Cl– kembali.
Oleh karena itu hidrolisis ini disebut hidrolisis sebagian karena hanya sebagian ion yang mengalami hidrolisis. Jadi garam yang berasal dari asam lemah dan basa lemah akan terhidrolisis sebagian.
47. Di antara campuran berikut ini, yang tidak dapat membentuk garam terhidrolisi adalah…
a. 100 ml CH3COOH 0,1 M + 100 ml NaOH
b. 100 ml HF 0,1 M + 100 ml KOH 0,1 M
c. 100 ml HCl 0,1 M + 100 ml NaOH 0,1 M
d. 100 ml HCl 0,1 M + 100 ml NH4OH 0,1 M
e. 100 ml HCOOH 0,1 M + 100 ml KOH 0,1 M
Jawaban : C
Pembahasan :
Ion – ion yang dihasilkan dari ionisasi garam yang berasal dari asam kuat dan basa kuat tidak ada yang bereaksi dengan air, sebab jika dianggap bereaksi maka akan segera terionisasi kembali secara sempurna membentuk ion-ion semula.
Jadi, HCl (asam kuat) dan NaOH (basa kuat) konsentrasi ion H+ dan ion OH– dalam air tidak akan terganggu, sehingga larutan bersifat netral.
48. Dari beberapa larutan berikut ini yang terhidrolisis sempurna adalah….
A. CH3COONa
B. CH3COONH4
C. NaCl
D. NH4Cl
E. NaCN
Jawaban : B
Penyelesaian :
Hidrolisis sempurna terjadi pada garam yang berasal asam lemah dan basa lemah.
CH3COONH4 berasal dari CH3COOH (asam lemah) dan NH4OH(basa lemah)
49. Larutan garam yang mempunyai pH > 7 adalah…
a. KCl
b. NaCN
c. CuSO4
d. NH4Cl
e. K2SO4
Jawaban : B
Pembahasan :
Garam yang berasal dari asam lemah dan basa kuat maka larutan akan bersifat basa, pH nya > 7. NaOH (basa kuat) sedangkan HCN (asam lemah).
50. Perhatikan persamaan reaksi berikut!
- (1) CH3COO− + H2O ⇌ CH3COOH + OH−
- (2) CN− + H2O ⇌ HCN + OH−
- (3) Al3+ + 3H2O ⇌ Al(OH)3 + 3H+
- (4) NH4+ + H2O ⇌ NH4OH + H+
- (5) S2− + 2H2O ⇌ H2S + 2OH−
Pasangan reaksi hidrolisis untuk garam yang bersifat asam adalah ….
a. 1 dan 2
b. 1 dan 3
c. 2 dan 3
d. 3 dan 4
e. 4 dan 5
Jawaban : D
Pembahasan :
Reaksi hidrolisis yang bersifat asam pada reaksi di atas ditandai dengan dihasilkannya ion H+. Sedangkan reaksi hidrolisis yang bersifat basa ditandai dengan dihasilkannya ion OH−.
Dengan demikian, reaksi nomor 1, 2, dan 4 adalah reaksi hidrolisis untuk garam yang bersifat basa. Sedangkan reaksi nomor 3 dan 4 merupakan reaksi hidrolisis yang garamnya bersifat asam.
51. Jika Kw air = 10-14 dan Ka HCN = 10-14 maka larutan NaCN 0,01 M dalm air akan mempunyai pH sebesar…
a. 3
b. 4
c. 8
d. 9
e. 10
Jawaban : D
Penyelesaian :
pOH = – log 10-5
= 5
pH = 14 – 5
= 9
52. Berikut ini adalah uji kelarutan sifat asam/basa dari beberapa garam.
No | Rumus Garam | Uji Lakmus | |
Merah | Biru | ||
1 | NaCl | Merah | Biru |
2 | CH3COONa | Biru | Biru |
3 | NH4Cl | Merah | Merah |
4 | Na2SO4 | Biru | Biru |
5 | NaCN | Merah | Biru |
Garam yang mengalami hidrolisis dan sesuai dengan hasil uji lakmusnya adalah ….
a. (1), (2) dan (3)
b. (1), (2) dan (4)
c. (2), (3) dan (4)
d. (2), (3) dan (5)
e. (3), (4) dan (5)
Jawaban: A
Pembahasan
- NaCl terbentuk atas basa kuat dan asam kuat. Larutan garam ini bersifat netral dan ketika uji lakmus, maka lakmus merah tetap merah dan lakmus biru tetap biru
- CH3COONa terbentuk atas basa kuat dan asam lemah. Larutan ini garam bersifat basa dan ketika uji lakmus maka lakmus merah menjadi biru dan lakmus biru tetap biru
- NH4Cl terbentuk atas basa lemah dan asam kuat. Larutan garam ini bersifat asam dan ketika uji lakmus maka lakmus merah tetap merah dan lakmus biru menjadi merah
53. Kelompok garam yang mengalami hidrolisis anionnya adalah …
a. NaCN, CH3COONa, NaHCO3
b. NaCl, NH4Cl, ZnCl2
c. NaHCO3, ZnCl2, NH4Cl
d. NH4Cl, MgCl2, NaCN
e. CH3COONa, NaCl, NH4Cl
Jawaban : B
Pembahasan
Garam merupakan senyawa ion yang terdiri dari kation logam dan anion sisa asam. Kation garam dapat dianggap berasal dari suatu basa, sedangkan anionnya berasal dari suatu asam.
Jadi setiap garam mempunyai komponen basa (kation) dan asam (anion).
- NaCl → Na+ kation (aq) + Cl-anion(aq)
- NH4Cl → NH4+ (aq) + Cl–
- ZnCl2 → Zn + 2Cl–
54. Pasangan senyawa berikut yang mengalami hidrolisis total adalah …
a. NH4Cl dan AlCl3
b. NH4CN dan Al2(SO4)3
c. CaCN dan CH3COONa
d. Na2CO3 dan ZnCl2
e. CH3COONH4 dan NH4CN
Jawaban : E
Pembahasan
Garam yang berasal dari asam lemah dan basa lemah mengalami hidrolisis total dan dikatakan terhidrolisis sempurna
CH3COONH4(aq) → CH3COO–(aq) + NH4+(aq)
H2O(l) ⇌ H+(aq) + OH–(aq)
Karena CH3COOH asam lemah maka ion CH3COO– dari garam beraksi dengan ion H+ dari air. Demikian juga, karena NH3 basa lemah maka ion NH4+ dari garam bereaksi dengan ion OH– dari air reaksinya sbb:
CH3COO–(aq) + H+(aq) ⇌CH3COOH(aq)
NH4+(aq) + OH–(aq) ⇌ NH4OH(aq)
NH4CN(aq) → NH4+(aq) + CN–(aq)
Ion NH4+ bereaksi dengan air membentuk reaksi kesetimbangan. Hidrolisis garam yang berasal dari asam lemah merupakan hidrolisis total, sebab kedua ion garam mengalami reaksi hidrolisis dengan air.
55. Berapa gram NH4Br harus dilarutkan dalam 500 ml larutan untuk mendapatkan larutan dengan pH = 5- log 2 …
(Kb NH4OH = 1,8 x 10-5, Ar N = 14, H = 1 Br = 80)
a. 24,5 gram
b. 35,3 gram
c. 24,2 gram
d. 37,4 gram
e. 45,7 gram
Jawaban : B
Pembahasan :
Baca Juga : Kumpulan Soal dan Pembahasan Ujian Nasional Kimia SMA Tahun 2019
56. Air akan berubah pHnya menjadi lebih kecil dari 7, jika kedalam air di larutkan garam …
a. NaCN
b. NH4Cl
c. CH3COONa
d. NaCl
e. K2SO4
Jawaban : B
Pembahasan :
Air akan berubah pHnya menjadi lebih kecil dari 7, jika kedalam air di larutkan garam NH4Cl karena garam ini terbentuk dari basa lemah dan asam kuat. Dalam air garam akan terionisasi sbb:
NH4Cl(aq) → NH4+(aq) + Cl–(aq)
H2O(l) ⇌ H+(aq) + OH–(aq)
10-7 10-7
Karena NH3(aq)basa lemah maka maka ion NH4+ dari garam bereaksi dengan ion OH– dari air, reaksi sbb:
NH4+(aq) + OH–(aq)⇌ NH3(aq) + NH3(aq)
Karena HCl asam kuat maka ion H+ tidak bereaksi dengan ion Cl–. Berarti garam NH4Cl hanya mengalami hidrolisis sebagian atau terhidrolisis parsial. Akibatnya:
- [OH–] berkurang, lebih kecil dari 10-7 karena diikat ion NH4+
- [H+] bertambah, lebih besar dari 10-7 karena kesetimbangan bergeser ke kanan (bergeser kearah yang berkurang)
- pH larutan lebih kecil dari 7
- larutan bersifat asam
57. Senyawa yang larutannya dalam air yang tidak mengalami hidrolisis adalah …
a. NH4Cl
b. K2SO4
c. CH3COOK
d. (NH4)2SO4
e. CH3COONH4
Jawaban : B
Pembahasan :
Yang tidak mengalami peristiwa hidrolisis adalah garam yang berasal dari asam kuat dan basa kuat. K2SO4 berasal dari KOH dan H2SO4 yang masing-masing berturut-turut merupakan basa kuat dan asam kuat.
K2SO4tidak mengalami hidrolisis
K2SO4 → 2K+ + SO4–
K+ + H2O → tidak ada reaksi (basa kuat)
SO42- + H2O → tidak ada reaksi (asam kuat)
Sifat larutan netral
58. Garam dibawah ini yang dilarutkan ke dalam air mengalami hidrolisis, kecuali …
a. CH3COOK
b. (NH4)2SO4
c. CH3COONH4
d. NaCl
e. Al2S3
Jawaban: D
Pembahasan
NaOH (aq) + HCl (aq) → NaCl (aq) + H2O (l)
NaCl (aq) → Na+ (aq) + Cl– (aq)
ion Na+ berasal dari basa kuat dan ion Cl- juga berasal dari asam kuat, jadi kedua ion tersebut merupakan asam dan basa Bronsted-Lowry lemah sehinga keduanya tidak bereaksi dalam air (tidak terhidrolisis).
Oleh karena itu larutan bersifat netral atau pH = 7
59. Diberikan persamaan hidrolisis berikut:
Z–(aq) + H2O(l) → HZ(aq) + OH–(aq)
Garam berikut ini yang mengalami hidrolisis seperti persamaan hidrolisis diatas adalah ….
a. NH4Cl
b. NH4CN
c. CaCl2
d. Na2SO4
e. KCN
Jawaban : E
Pembahasan
Persamaan diatas adalah persamaan hidrolisis dari asam lemah dan basa kuat. Dari data pada soal, garam yang berasal dari basa kuat dan asam lemah adalah KCN.
KCN(aq) + H2O → HCN (aq) + K+ + OH–(aq)
60. Garam yang memiliki pH > 7 dalam larutannya adalah …
a. NaCl
b. Na2SO4
c. NH4Cl
d. K2CO3
e. K2SO4
Jawaban : D
Pembahasan
Garam yang berasal dari asam lemah dan basa kuat maka larutan akan bersifat basa`
2KOH + H2CO3 → K2CO3 + 2H2O
KOH adalah basa kuat sehingga ion K+ tidak bereaksi dengan ion OH–. Berarti garam K2CO3 hanya mengalami hidrolisis sebagian dan disebut mengalami hidrolisis sebagian atau hidrolisis parsial, akibatnya pH larutan lebih besar dari 7
61 – 70 Soal Kelas 11 SMA Semester 1 Pilihan Ganda dan Jawaban
61. Suatu larutan mengandung garan – garam Fe(NO3)2, Mn(NO3)2, dan Zn(NO3)2 masing-masing dengan konsentrasi 0,01 M. kedalam larutan ini ditambahkan NaOH padat sehingga didapatkan pH larutan adalah 8. Jika Ksp hidroksida dari :
- Fe(NO3)2 = 2,8 x 10-16
- Mn(NO3)2 = 4,5 x 10-14
- Zn(NO3)2 = 4,5 x 10-17
Hidroksi yang mengendap adalah . . . .
a. Tidak ada
b. Ketiga – tiganya
c. Hanya Zn(NO3)2
d. Hanya Mn(NO3)2
e. Zn(NO3)2 dan Fe(NO3)2
Jawaban : E
Pembahasan
62. Berapakah pH larutan jenuh magnesium hidroksida (Mg(OH)2) pada 25°C? (pada 25°C, Ksp = 6,0 x 10-12)
a. 10,56
b. 10,36
c. 10,26
d. 9,36
e. 5,36
Jawaban : B
Pembahasan
63. Jika senyawa Pb3(PO4)2 dilarutkan dalam air dan kelarutannya diberi lambang s, maka senyawa tersebut memiliki nilai Ksp . . .
a. S2
b. 4s3
c. 27s4
d. 108s5
e. 108s6
Jawaban : D
Pembahasan
64. Sebanyak 0,7 gram BaF2 (Mr = 175 ) melarut dalam air murni membentuk 2 L larutan jenuh. maka ksp dari BaF2 …
a. 3,3 x 10-2
b. 3,4 x 10-3
c. 3,2 x 10-8
d. 3,5 x 10-4
e. 4,2 x 10-9
Penyelesaian :
Jawaban : C
65. Dalam 100 cm3 air dapat larut 1,16 Mg(OH)2 (Mr = 58). Harga Ksp dari Mg(OH)2 adalah….
a. 16,0 x 10-12
b. 3,2 x 10-11
c. 8,0 x 10-10
d. 4,0 x 10-10
e. 8,0 x 10-8
Penyelesaian :
Jawaban : B
Baca Juga : Kumpulan Buku
66. Kelarutan Mg(OH) dalam NaOH 0,1 M dengan Ksp Mg(OH)2 = 1,8 x 10-11 mol-3 L-3 adalah….
a. 1,8 x 10-13 mol/L
b. 1,8 x 10-10 mol/L
c. 4,5 x 10-10 mol/L
d. 1,8 x 10-9 mol/L
e. 6,7 x 10-6 mol/L
Penyelesaian :
Jawaban : D
67. Larutan jenuh X(OH)2 Memiliki pOH = 5. maka hasil kali kelarutan (Ksp) dari X(OH)2 tersebut….
a. 4 x 10-3
b. 4 x 10-9
c.2 x 5-12
d. 5 x 10-16
e. 7 x 10-13
Penyelesaian :
Jawaban : D
68. Larutan jenuh senyawa Hidroksida dari suatu logam, M(OH)2 mempunyai Ph = 9 Nilai Ksp (hasil kali kelarutan ) dari senyawa ini adalah….
a. 3,3 x 10-21
b. 3,0 x 10-20
c. 1,0 x 10-10
d. 3,0 x 10-35
e. 3,3 x 10-37
Jawaban : A
Penyelesaian :
69. Pada suhu tertentu kelarutan PbCl2 dalam air adalah 2,5 x 10-2 Hasil Kali kelarutan (Ksp) PbCl2 adalah….
a. 6,25 x 10-6
b. 6,25 x 10-5
c. 6,25 x 10-4
d. 7,25 x 10-4
e. 7,5 x 10-4
Jawaban : B
Penyelesaian :
70. Kelarutan garam Sr3(PO4) dalam air adalah α mol/lt. Ksp garam tersebut adalah….
a. Α4
b. 27 α4
c. α 5
d. 108 α5
e. 265 α5
Jawaban : D
Penyelesaian :
Sudah selesai membaca dan berlatih soal ini ? Ayo lihat dulu Daftar Soal Kimia lainnya

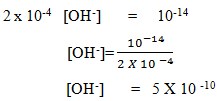
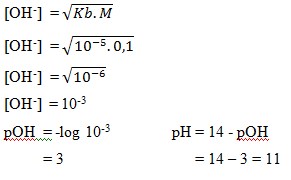
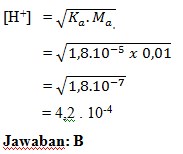
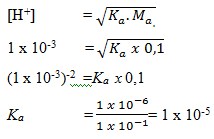


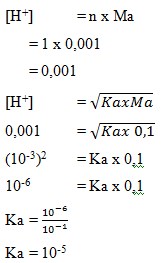
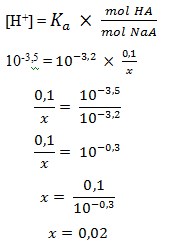
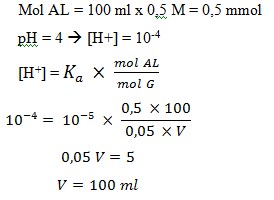
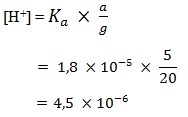
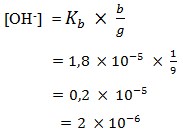
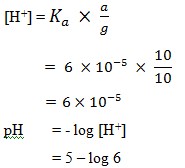
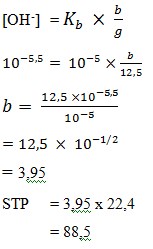
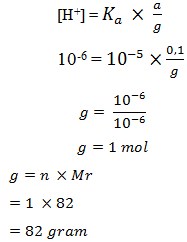
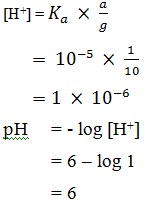
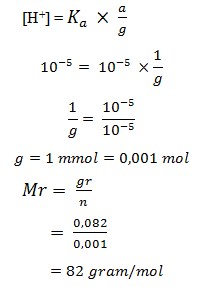
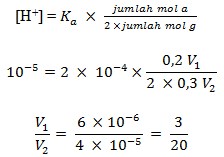
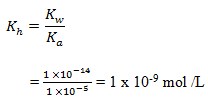
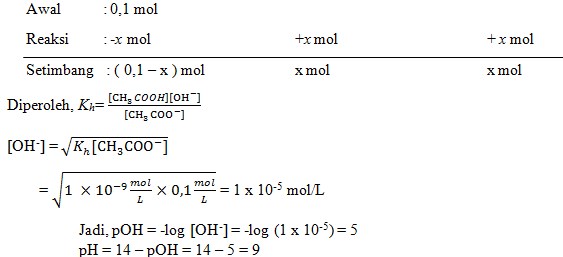
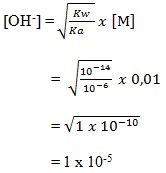


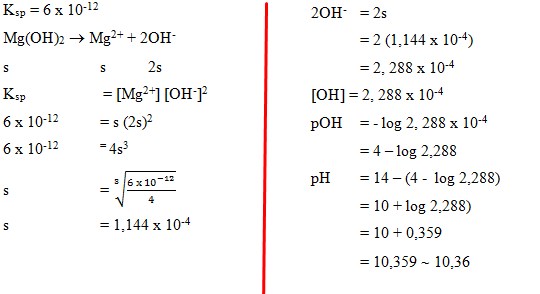
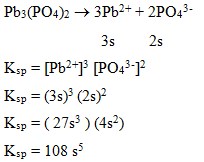

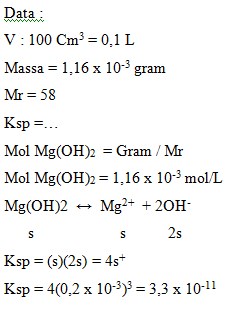



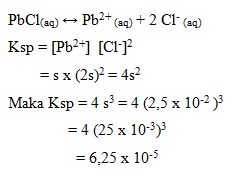
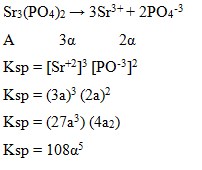



Wah lengkap terimakasih banyak min
Lenkap sekali dan mudah di mengerti
Makasih ya🙏🙏🙏
wahhh bags sekali lengkap dan mud dimengerti
baik sekali mudah-mudahan jadi kebaikan bagi oarang lain
SEMOGA ALLAH swt AKAN MEMBALAS KEBAIKAN BAPAK
keren lebih senang belajar dan mengajarnya
Terima kasih Pak. Bisa dijadikan referensi latihan soal anak-anak.
Sayangnya tidak bisa di download
TERIMA KASIH Pak ..Luar Biasa..Lebih mudah dan praktis untuk memberikan pemantapan soal – soal dalam menghadapi ulangan semester maupun ujian..